Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 879 questões

Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
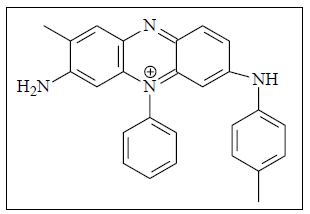
A história mostra que a determinação da estrutura da mauveína não foi fácil de ser alcançada. De modo satisfatório, a estrutura química deste corante só foi conseguida em 1994. De fato existem quatro compostos denominados de mauveína, sendo um deles (mauveína A) apresentado ao lado.
Com base nesta estrutura, pode-se dizer que a mauveína A é um composto
( ) Se a marca 0 ºC e c marca 100 ºC, b pode representar a temperatura de um corpo humano febril. ( ) Se a marca b é alcançada quando o termômetro está em equilíbrio térmico com água a 4 ºC, é possível afirmar que a pode representar a temperatura da água a 3 ºC, se a substância X for o mercúrio. ( ) Se Tb > Ta, então, obrigatoriamente, Tc > Tb, independente da substância X.

Assinale a seqüência correta.
Considere: 1 cal = 4,2J L = 540 cal/g
Acho que deveríamos consumir mais epigalocatequina-3-galato (EGCG). Isso porque a EGCG, como foi misericordiosamente abreviada, pode oferecer proteção significativa contra as duas maiores pragas de nosso tempo: o câncer e as doenças do coração. E as boas novas são que, para colher seus benefícios, não temos de engolir pílulas, beber estranhas misturas ou comer broto de feijão; só devemos adquirir o hábito de beber chá. (SCHWARCZ, J. Barbies, bambolês e bolas de bilhar. Zahar, 2009.)
Na tradicional preparação de um chá pela sua imersão em água quente é possível separar, dentre outras substâncias, o EGCG da erva utilizada.
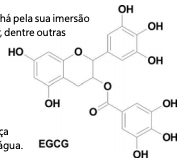
Essa separação ocorre por um método chamado:
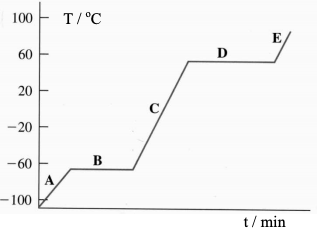
Analisando a curva, observa-se que: (a) a
temperatura de fusão; (b) a temperatura de
ebulição; (c) o estado físico do clorofórmio nos
segmentos A e D, são respectivamente:
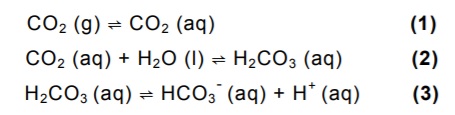
As etapas (1) e (3), mostradas na questão anterior, representam, respectivamente, processos de:
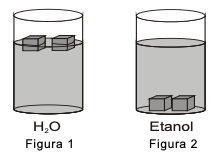
O fato de o gelo flutuar no copo da Figura 1 e afundar no copo da Figura 2 se explica porque, comparativamente, a densidade
O vazamento de petróleo, proveniente de navios petroleiros, geralmente identificado pelas grandes manchas negras de óleo sobre a superfície dos mares e sobre a areia de praias da costa brasileira, vem causando danos irreparáveis à vida marinha.
A partir dessas informações, é correto afirmar:
A partir da utilização desses modelos de ligação química na compreensão da estrutura molecular de algumas substâncias, é correto afirmar:
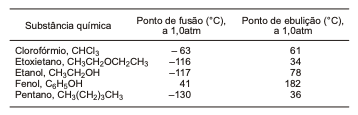
A partir da análise dos dados dessa tabela, que apresenta as
propriedades físicas de algumas substâncias químicas, é
correto afirmar:


Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.