Questões de Vestibular
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 140 questões
Dado: massa molar do HCl = 36,5 g/mol.
O H2SO4 é capaz de diminuir o pH da água da chuva porque reage com a água, em uma reação chamada hidrólise, que gera o íon hidrônio (H3O+ ) em solução aquosa; essa reação está corretamente descrita na equação a seguir, em que o H2SO4 atua como um ácido de Brønsted-Lowry e a água, como uma base de Brønsted-Lowry.
H2SO4 (aq) + H2O (l) → H3O+ (aq) + HSO4 − (aq)
http://www.educadores.diaadia.pr.gov.br/arquivos/File/outubro2011/quimica_artigos/olhar_hist_quim_brasil_art.pdf. Acessado em 07 de março de 2022. Adaptado.
Os produtos químicos, destacados no texto, são exemplos de ácidos inorgânicos. A reação de neutralização total de 2 mols de cada um dos ácidos com o hidróxido de sódio, respectivamente, produzirão uma certa quantidade de mols de óxido de hidrogênio.
Qual a quantidade total do óxido formada, considerando todas as neutralizações?

Numa aula de artes, solicitou-se aos alunos que fizessem uma releitura dessa obra utilizando uma “tinta” preparada com extrato de repolho roxo. Esse extrato fica rosa em valores de pH menores que 5 e azul em valores próximos a 8, conforme figura a seguir, que mostra a cor da solução em diferentes valores de pH.

Com base no exposto, qual das alternativas apresenta compostos ou produtos que poderiam ser usados para preparar uma “tinta” rosa/vermelha e uma azul/verde empregando o extrato de repolho roxo?
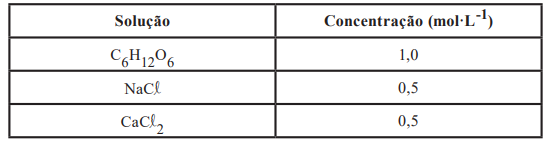
A respeito do comportamento dessas soluções, são realizadas algumas afirmações. I. A solução de glicose é aquela cuja condução de corrente elétrica será a maior sob mesma temperatura. II. Os pontos de ebulição das soluções salinas serão iguais. III. Todas as soluções apresentarão a mesma concentração de partículas dissolvidas.
Das afirmações acima,
Observe a escala abaixo:

O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala acima, que relaciona a cor final do sistema substância + indicador com o pH aproximado que ela possui. Ao testar algumas soluções com o suco de repolho roxo, foram obtidos os seguintes resultados:
- Amoníaco: verde
- Leite de magnésia: azul
- Vinagre: vermelho
- Leite de vaca: rosa
Com base nessas informações, as substâncias amoníaco, leite de magnésia, vinagre e
leite de vaca têm caráter respectivamente:
Uma das substâncias abaixo que possui caráter ácido é
O ácido oxálico (H2C2O4) está presente em caules e folhas de vegetais como o espinafre e a beterraba. Uma maneira de quantificar a concentração de ácido oxálico nos vegetais é através da titulação com hidróxido de sódio (NaOH). Para realizar uma titulação, pretende-se escolher um indicador adequado para o ponto de equivalência mostrado no gráfico. O quadro apresenta os indicadores disponíveis no laboratório.


Sobre o clorato de potássio e suas propriedades NÃO é correto afirmar que

Completam as lacunas do texto, respectivamente,
Na coluna da direita abaixo, estão listados compostos inorgânicos; na da esquerda, sua classificação. Associe adequadamente a coluna da esquerda à da direita.
( ) Oxiácido forte
( ) Hidrácido fraco
( ) Base forte
( ) Base fraca
1. Óxido de zinco
2. Hidróxido de alumínio
3. Ácido cianídrico
4. Hidróxido de potássio
5. Ácido sulfúrico
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Considere a reação abaixo.

Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
O composto BF3 apresenta uma geometria ........ e atua como ........ ao reagir com água.
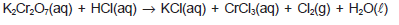
O dicromato de potássio reage com ácido clorídrico, de acordo com a equação química não balanceada apresentada.
Em relação a essa equação química e aos conhecimentos sobre classificação periódica, funções inorgânicas e reações químicas, pode-se afirmar:
Os óxidos emitidos nesse processo e transformados na atmosfera são depositados no solo, ocasionando a sua
Equações:
I) NaOH + CH3COOH → CH3COONa + H2O II) Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O III) NH4OH + HCl → NH4Cl + H2O
O papel tornassol ficará azul em contato com a solução resultante, na/nas reação/reações: