Questões de Vestibular
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 140 questões
Ordene a segunda coluna de acordo com a primeira, de forma a estabelecer a relação entre elas.
Coluna 1
A – Efeito da acidez
B – Efeito da temperatura
C – Exemplo de substância orgânica
D – Exemplo de substância apolar
E – Explosão
F – Reação de simples troca entre um metal e um sal
Coluna 2
( )Esverdeamento da gema
( )Aumento da pressão
( )Ao envelhecer, o deslocamento do equilíbrio leva ao descolamento da membrana interna do ovo
( )Sulfeto de ferro
( ) Colesterol
( )Água
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Leia o texto para responder à questão.
Na Estação de Tratamento de Água (ETA), diferentes substâncias químicas são adicionadas à água nos diversos tanques por onde ela passa. No tanque de floculação, por exemplo, a adição de certas substâncias químicas estimula a formação de um composto gelatinoso, o hidróxido de alumínio, que provoca a aglutinação das partículas de sujeira. Essas partículas aderem ao composto gelatinoso, formando flóculos sólidos de tamanho maior, que são facilmente sedimentáveis.

(www.sobiologia.com.br. Adaptado.)
A substância química gelatinosa formada no tanque de floculação apresenta caráter __________ e valor de pH ____________ 7 a 25 ºC. Ao combinar-se com um ácido, essa substância forma ____________e _____________ , ocorrendo uma reação de _____________.
Completam as lacunas do texto, respectivamente,
A contaminação de ecossistemas em função do crescimento populacional e da industrialização tem sido cada vez maior ao longo dos anos, mesmo com o advento de tecnologias voltadas à descontaminação ambiental. Um dos efeitos deletérios ao ambiente é a elevada acidez da chuva e de solos. A figura a seguir mostra o efeito que a acidez do solo causa na velocidade de lixiviação de íons Cd2+.
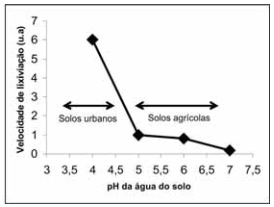
Dados: Kps para Cd(OH)2(s) = 2,5 x 10−14
Quanto maior a velocidade de lixiviação, maior o transporte de Cd2+ para os lagos por meio da corrente superficial ou subsuperficial, transferido para os aquíferos ou absorvido pela vegetação, com efeitos tóxicos.
Com base na figura e nos conhecimentos sobre solubilidade de metais e equilíbrio químico, é correto afirmar que
a lixiviação de cádmio
I - O grau de ionização de um ácido fraco, como o ácido acético, aumenta com o aumento da diluição. II - A maior concentração de um ácido forte acarreta maior grau de ionização e maior constante de ionização. III- A segunda constante de ionização de um ácido poliprótico é sempre menor que a primeira constante.
Quais estão corretas?
Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
( ) A sílica, presente na areia, e o gás carbônico fazem parte da mesma função inorgânica: os óxidos.
( ) O número de oxidação do oxigênio, no composto OF2, é – 2.
( ) O óxido de alumínio pode comportar-se como óxido ácido ou como óxido básico.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Tradicionalmente, dividem-se os compostos inorgânicos em quatro classes, por apresentarem características semelhantes em termos de reatividade e características químicas. Sobre esse tema, analise as proposições.
I. Óxidos são compostos binários que têm dois elementos (iônicos ou moleculares). Possuem oxigênio na sua composição, sendo ele o elemento mais eletronegativo.
II. Ácidos, segundo Arrhenius, são substâncias que, em solução aquosa, geram o íon H3O+ .
III. CO2 é classificado como um óxido básico, que reage com a água, tornando o meio ácido, devido à produção de ácido carbônico (H2CO3).
IV. A maneira mais simples de se obter um sal é por meio de uma reação de neutralização entre uma base e a água.
V. Em comparação ao ácido clorídrico, o ácido acético é um ácido classificado como forte, pois se ioniza completamente em água.
VI. Sais são péssimos condutores de eletricidade em estado sólido, mas quando dissolvidos em água formam íons, o que possibilita então a condução de eletricidade.
Assinale a alternativa correta.
O hidróxido de cálcio, Ca(OH)2 , pode ser neutralizado com H2 SO4 , de acordo com a equação química balanceada representada a seguir:
H2 SO4 (aq) + Ca(OH)2 (aq) → CaSO4 (aq) + 2 H2 O(l)
A respeito das espécies químicas que participam dessa reação de neutralização, verifica-se que o
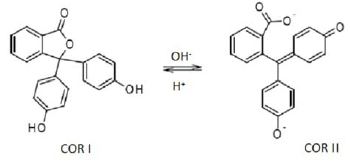
Sobre esses dados é correto afirmar que
Analise as afirmativas.
I - A elevação do pH de uma piscina favorece a dissolução dos floculantes presentes na água.
II - O pH de um suco de tomate, em média, deverá ser igual a 4,2 – aproximadamente 1000 vezes mais ácido que a água de uma piscina em boas condições.
III - No tratamento de uma piscina é comum a utilização de barrilha (Na2CO3 – carbonato de sódio) para a elevação do pH, pois produz uma solução de caráter alcalino.
IV - No tratamento de microrganismos em piscinas, é comum a utilização de sais de hipoclorito, que fornecem à água o íon Cl-(aq) .
São verdadeiras, apenas

A daminozida, também conhecida como Alar, é um regulador do crescimento de plantas, usado na pulverização de frutas, como
maçãs, para tornar mais fácil a colheita e evitar a queda das frutas antes do amadurecimento. O Alar garante a cor vermelha
e a firmeza da fruta para embalagem. A Agência de Proteção Ambiental dos Estados Unidos proibiu, em 1989, o uso da substância
química para consumo humano, em razão de apresentar alto risco carcinogênico. O produto da degradação da daminozida, a
dimetil-hidrazina assimétrica, UDMH, usada em combustíveis para foguetes espaciais e mísseis, é também carcinogênico.
Normalmente, os riscos e a quantidade de aditivo de alimentos consumidos na ingestão de maçãs não são informados pelos
produtores e distribuidores de frutas.
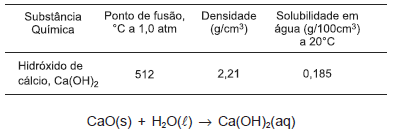
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
Com relação aos conceitos sobre ácidos e bases, três afirmações foram feitas:
1) Na reação de dissociação do HCl em água: HCl(g) + H2O(l)
 H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)
H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)  NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
Está(ão) correta(s) a(s) afirmativa(s):
Química orgânica
Há mulheres altas e mulheres baixas; mulheres bonitas e mulheres feias; mulheres gordas e mulheres magras; mulheres caseiras e mulheres rueiras; mulheres fecundas e mulheres estéreis; (...) Mas, do que pouca gente sabe é que há duas categorias antagônicas de mulheres cujo conhecimento é da maior utilidade, de vez que pode ser determinante na relação desses dois sexos que eu, num dia feliz, chamei de "inimigos inseparáveis". São as mulheres "ácidas" e as mulheres "básicas", qualificação esta tirada à designação coletiva de compostos químicos que, no primeiro caso, são hidrogenados, de sabor azedo; e no segundo, resultam da união dos óxidos com a água e devolvem à tintura do tornassol, previamente avermelhada pelos ácidos, sua primitiva cor azul.
Texto retirado de http://www.viniciusdemoraes.com.br/ptbr/prosa/quimica-organica Acesso em 23 de agosto de 2017.
O texto cita um indicador que muda de coloração de acordo com a característica ácido-básica do meio em que é colocado. A partir das colorações que o indicador pode adquirir, a alternativa que indica um composto que é responsável por deixar azul o papel de tornassol, é:
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
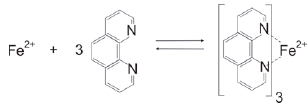
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
No século XIX, o cientista Svante Arrhenius definiu ácidos como sendo as espécies químicas que, ao se ionizarem em solução aquosa, liberam como cátion apenas o íon H+ . Considere as seguintes substâncias, que apresentam hidrogênio em sua composição: C2H6 , H2SO4 , NaOH, NH4Cl.
Dentre elas, aquela classificada como ácido, segundo a definição de Arrhenius, é:
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
2FeS2(s) + 7 O2(g) + 2H2O(ℓ) → 2 Fe2+(aq) + 4SO2-4(aq) + 4H+(aq)
2Fe2+(aq) + ½ O2(g) + 2H+(aq) → 2Fe3+(aq) + H2O(ℓ)
2 Fe3+(aq) + 6 H2O(ℓ) → 2 Fe(OH)3 (s) + 6 H+(aq)
Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do FeS2 (s) e do O2 (g) é __________, e, durante o processo, o pH do solo __________” podem ser corretamente preenchidas por