Questões de Vestibular
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 140 questões
I. O ferro presente na hematita apresenta número de oxidação igual a +2.
II. De acordo com o processo, para cada mol de hematita adicionada, são utilizados 3 mol de monóxido de carbono.
III. Para um rendimento global igual a 50%, a massa de ferro formada a partir de 1280 kg de hematita é de 448 kg.
IV. O gás carbônico dissolvido em água forma uma solução que apresenta valor de pH maior do que 7.
Dadas as massas molares (g/mol): C = 12, O = 16 e Fe = 56.
Fe2+(aq) + HCO-3 + O2(aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
A partir da compreensão dessa informação, é correto afirmar:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
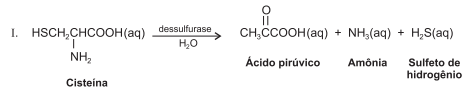
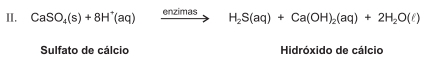
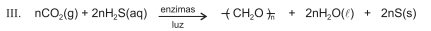
As plantas utilizam enxofre, sob forma de sulfato, SO2-4 , para a síntese dos aminoácidos cisteína, cistina e meteonina, que são componentes essenciais de algumas proteínas. Quando as plantas morrem, os micro-organismos do solo degradam as proteínas e liberam aminoácidos, que, por sua vez, são degradados por enzimas dessulfurase, como mostra a equação química I. O íon sulfato pode ser transformado em sulfeto de hidrogênio, H2S, por vários organismos do solo, como as bactérias dessulfotomaculum, que podem realizar a reação de acordo com a equação química II.
Algumas espécies de bactérias fototrópicas verdes e púrpuras podem oxidar sulfeto de hidrogênio a enxofre elementar, conforme evidencia a equação química III.
A partir da análise dessas considerações sobre as transformações do enxofre na natureza, é correto afirmar:
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3 .
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
Quando borbulhado em água, o H2S comporta-se como ácido fraco, estabelecendo-se os equilíbrios simultâneos representados pelas equações a seguir:
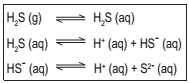
Dentre os procedimentos a seguir, o único que provoca um aumento do escape de sulfeto de hidrogênio de uma solução aquosa para o ar é
A sibutramina, cuja estrutura está representada, é um fármaco indicado para o tratamento da obesidade e seu uso deve estar associado a uma dieta e exercícios físicos.
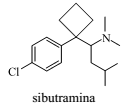
Com base nessa estrutura, pode-se afirmar que a sibutramina:
Distribuição esquemática de íons
de um sal dissolvido em água
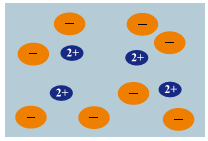
O composto que representa melhor a solução esquematizada na figura é:
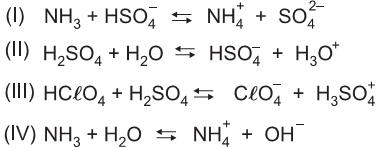
De acordo com a teoria ácido-base de Brönsted-Lowry, é CORRETO afirmar que:
I. leite de magnésia (suspensão aquosa de hidróxido de magnésio);
II. limonada ( suco de limão, água e açúcar);
III. salmoura ( cloreto de sódio dissolvido em água).
Assinale a alternativa que classifca, corretamente, essas três misturas.
O gás carbônico é um óxido de característica ácida, pois, ao reagir com a água, produz ácido carbônico.
Com relação a essas substâncias, assinale a afirmação correta.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O Al(OH)3 é uma tribase de Arrhenius.
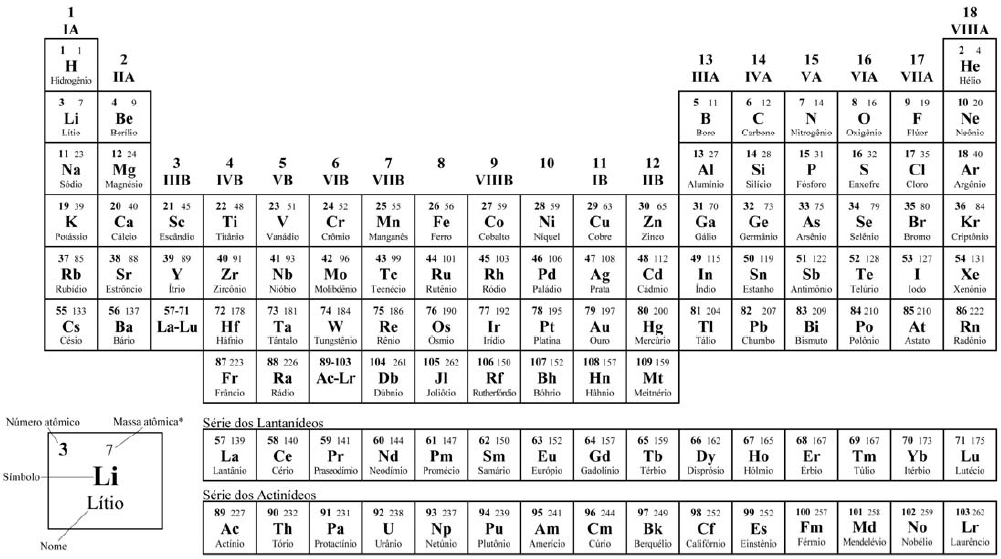
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Com o auxílio das informações a seguir, sobre três dos elementos do Grupo 1 da Tabela Periódica, assinale a alternativa correta.
Elementos Raio atômico (nm) 1.ª Energia de Ionização (kJ/mol)
Li 0,123 520,0
Na 0,157 496,0
K 0,203 419,0
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
I. CaC2(s) + N2(g) 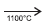 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:

