Questões de Vestibular
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 140 questões

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
No processo de ionização, um átomo neutro recebe um elétron, liberando energia.
CO2(g), dissolvido em água, H2CO3 no meio aquoso, e HCO3-, no meio aquoso, encontram-se em equilíbrio de acordo com as representações abaixo:
(I) CO2(aq) + H2O
 H2CO3 (aq)
(II) H2CO3(aq) + H2O
H2CO3 (aq)
(II) H2CO3(aq) + H2O HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H3O+(aq)(III) HCO3- (aq) + H2O
 CO32-(aq) + H3O+(aq)
CO32-(aq) + H3O+(aq)Sobre esse comportamento é correto afirmar que:

I - Para Lewis, uma base caracteriza-se por ser capaz de receber um par de elétrons.
II - Segundo a de? nição de base por Brønsted-Lowry, o propranolol comporta-se como base por receber um H+.
III - No conceito de Arrhenius, um ácido é aquela substância que libera íons H+ em solução aquosa.
É correto APENAS o que se afirma em:

A infraestrutura precária de alguns locais que sediam
eventos com grande público, como jogos de futebol e shows
musicais, e a falta de educação de pessoas que insistem em urinar
em locais completamente inapropriados, como paredes e viadutos,
têm causado sérios problemas. Além do mau cheiro, o ácido úrico,
presente na urina, penetra pelos poros do concreto e causa corrosão
de estruturas metálicas.
vezes, são negligenciadas. Entre elas, destaca-se o emprego de
revestimentos a base de poliuretano, um polímero altamente
inflamável que pode liberar, em sua combustão, gases tóxicos,
como o CO e o HCN.
Considerando o comportamento ideal para as soluções envolvidas,
julgue os itens subsequentes.
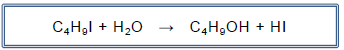
Nessas condições, o HI, que é um dos produtos da reação, comporta-se como um eletrólito forte e solúvel. Dessa forma, pode-se fazer um estudo da cinética dessa reação, medindo-se
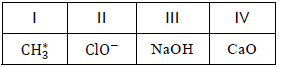
Em relação às informações que as fórmulas químicas oferecem, é correto afirmar:
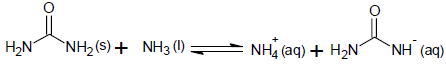
Sobre a natureza das interações entre as espécies envolvidas na reação, o comportamento químico das substâncias reagentes e o átomo de nitrogênio, é correto afirmar:
Cada tipo de planta cresce melhor em solos com faixa específica de pH. Os valores de pH do solo se devem à solução intersticial presente, ou seja, a água presente no solo e seus respectivos solutos. A tabela abaixo fornece a faixa de “pH ótimo” para algumas plantas, o que facilita a produtividade de flores e frutos.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0

Considerando essas informações, julgue os próximos itens.
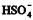 apresenta caráter anfótero em meio aquoso.
apresenta caráter anfótero em meio aquoso.
Conhecer essa linguagem é essencial para se compreender a química como ciência. As fórmulas químicas são representações que fazem parte de sua linguagem. A seguir, estão representadas quatro espécies químicas.
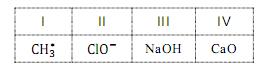
Em relação às informações que as fórmulas químicas oferecem, é correto afirmar:
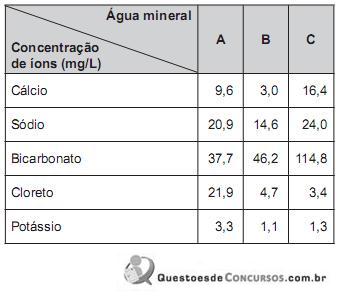
Pela análise comparativa das informações, é correto afrmar que
Considerando-se essas informações e as propriedades dos óxidos, é correto afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
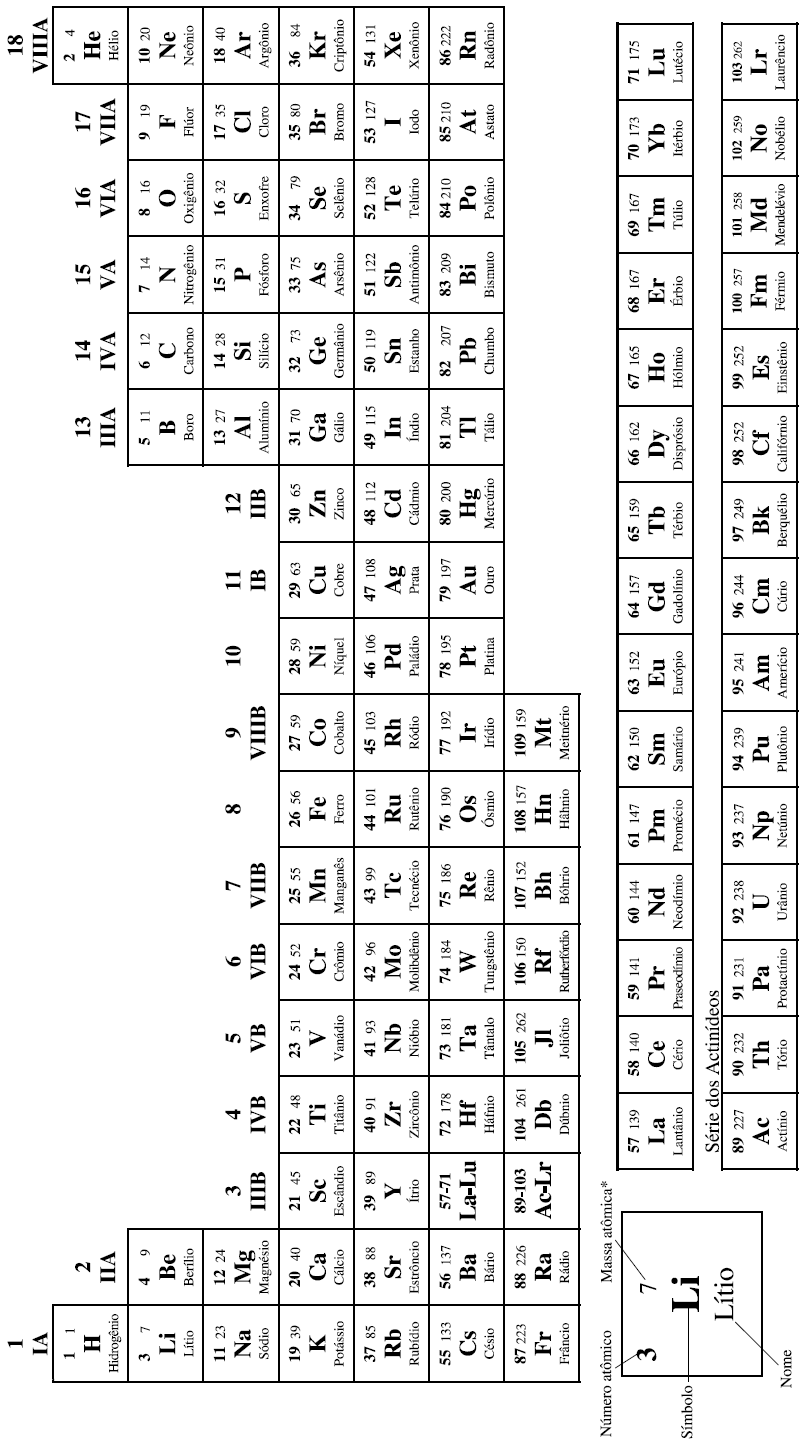
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol

Uma substância que pode ser incluída no cardápio de antiácidos por ter propriedades básicas é