Questões de Vestibular
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 385 questões
Tradicionalmente, dividem-se os compostos inorgânicos em quatro classes, por apresentarem características semelhantes em termos de reatividade e características químicas. Sobre esse tema, analise as proposições.
I. Óxidos são compostos binários que têm dois elementos (iônicos ou moleculares). Possuem oxigênio na sua composição, sendo ele o elemento mais eletronegativo.
II. Ácidos, segundo Arrhenius, são substâncias que, em solução aquosa, geram o íon H3O+ .
III. CO2 é classificado como um óxido básico, que reage com a água, tornando o meio ácido, devido à produção de ácido carbônico (H2CO3).
IV. A maneira mais simples de se obter um sal é por meio de uma reação de neutralização entre uma base e a água.
V. Em comparação ao ácido clorídrico, o ácido acético é um ácido classificado como forte, pois se ioniza completamente em água.
VI. Sais são péssimos condutores de eletricidade em estado sólido, mas quando dissolvidos em água formam íons, o que possibilita então a condução de eletricidade.
Assinale a alternativa correta.
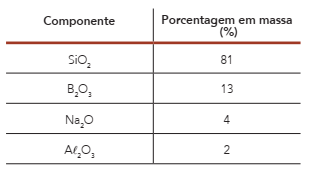
A tabela abaixo apresenta a composição química de uma amostra de 500 g de vidro borossilicato.

Na charge são lidas algumas substâncias que aparecem no "leite de caixinha", substâncias essas adicionadas com funções distintas na preservação e na conservação do produto.
As substâncias citadas na charge
NaOH + H3PO4 → Na3PO4 + H2O
Sabendo-se que Na=23, O=16, H=1 e P=31, qual a massa de ácido fosfórico (H3PO4) necessária para a obtenção de 200g de água?
A calcinação de 2.8400 g de uma mistura sólida constituída de CaCO3 e MgCO3 produziu um gás e um resíduo sólido de peso 1.5200 g.
Com essas informações, é correto afirmar que
No tratamento dos sintomas da acidez estomacal, emprega-se o hidróxido de alumínio, que neutraliza o excesso do ácido clorídrico produzido no estômago.
Na neutralização total, a quantidade de mols de ácido clorídrico que reage com um mol de hidróxido de alumínio para formação do sal neutro corresponde a:
Em um reservatório contendo água com pH igual a 7, houve um descarte acidental de ácido sulfúrico. Em seguida, foi adicionada uma determinada substância de caráter básico, em quantidade suficiente para neutralizar a acidez.
O gráfico que representa o comportamento do pH durante esse processo é:
O cloreto de sódio, principal composto obtido no processo de evaporação da água do mar, apresenta a fórmula química NaCl.
Esse composto pertence à seguinte função química:
Dados – M (g mol-1 ): O = 16; Al = 27; Fe = 56.
A partir de 5 toneladas de minério, a quantidade (em toneladas) de alumínio metálico produzida por eletrólise ígnea é mais próxima de:
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
TEXTO 8
IX
Horas depois, teve Rubião um pensamento horrível. Podiam crer que ele próprio incitara o amigo à viagem, para o fim de o matar mais depressa, e entrar na posse do legado, se é que realmente estava incluso no testamento. Sentiu remorsos. Por que não empregou todas as forças, para contê-lo? Viu o cadáver do Quincas Borba, pálido, hediondo, fitando nele um olhar vingativo; resolveu, se acaso o fatal desfecho se desse em viagem, abrir mão do legado.
Pela sua parte o cão vivia farejando, ganindo, querendo fugir; não podia dormir quieto, levantava-se muitas vezes, à noite, percorria a casa, e tornava ao seu canto. De manhã, Rubião chamava-o à cama, e o cão acudia alegre; imaginava que era o próprio dono; via depois que não era, mas aceitava as carícias, e fazia-lhe outras, como se Rubião tivesse de levar as suas ao amigo, ou trazê-lo para ali. Demais, havia-se-lhe afeiçoado também, e para ele era a ponte que o ligava à existência anterior. Não comeu durante os primeiros dias. Suportando menos a sede, Rubião pôde alcançar que bebesse leite; foi a única alimentação por algum tempo. Mais tarde, passava as horas, calado, triste, enrolado em si mesmo, ou então com o corpo estendido e a cabeça entre as mãos.
Quando o médico voltou, ficou espantado da temeridade do doente; deviam tê-lo impedido de sair; a morte era certa.
— Certa?
— Mais tarde ou mais cedo. Levou o tal cachorro?
— Não, senhor, está comigo; pediu que cuidasse dele, e chorou, olhe que chorou que foi um nunca acabar. Verdade é, disse ainda Rubião para defender o enfermo, verdade é que o cachorro merece a estima do dono; parece gente.
O médico tirou o largo chapéu de palha para concertar a fita; depois sorriu. Gente? Com que então parecia gente? Rubião insistia, depois explicava; não era gente como a outra gente, mas tinha coisas de sentimento, e até de juízo. Olhe, ia contar-lhe uma...
— Não, homem, não, logo, logo, vou a um doente de erisipela... Se vierem cartas dele, e não forem reservadas, desejo vê-las, ouviu? E lembranças ao cachorro, concluiu saindo.
Algumas pessoas começaram a mofar do Rubião e da singular incumbência de guardar um cão em vez de ser o cão que o guardasse a ele. Vinha a risota, choviam as alcunhas. Em que havia de dar o professor! sentinela de cachorro! Rubião tinha medo da opinião pública. Com efeito, parecia-lhe ridículo; fugia aos olhos estranhos, olhava com fastio para o animal, dava-se ao diabo, arrenegava da vida. Não tivesse a esperança de um legado, pequeno que fosse. Era impossível que lhe não deixasse uma lembrança.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática, 2011. p. 30-31.)
Marque a alternativa que apresenta todos os itens corretos:
I. A pólvora negra é uma mistura de carvão vegetal, nitrato de potássio e enxofre em que predominam substâncias representadas, respectivamente, por: C, KNO3 e S.
II. A neutralização do hidróxido de amônio é representada por: NH4 Cl(s) + H2 O(l) → NH4 + (aq) + OH- (aq) + H+ (aq) + Cl- (aq).
III. A combustão de uma porção de palha de aço é representada pela seguinte equação: 2 Fe(s) + O2(g) → 2 FeO(s)
IV. Os elementos químicos do terceiro período da tabela periódica − que estão, respectivamente, no segundo e terceiro grupos − são representados por: Mg e Al.
De acordo com as informações acima, são corretas apenas as afirmativas
Na bancada de um laboratório, existem quatro soluções aquosas, cada uma contendo dissolvido um dos seguintes eletrólitos listados abaixo.
I. NaCl
II. NaOH
III. HCl
IV. CH3COONa
Considerando concentrações, em quantidade de matéria, equivalentes, as soluções teriam os valores de pH na seguinte ordem crescente:
Em linhas gerais, o consumo de água aumentou de forma considerável em todo o planeta ao longo do tempo. Em 1900, o mundo consumia cerca de 580 km³ de água; já em 1950, esse consumo elevou-se para 1400 km³, passando para 4000 km³ em 2000. Segundo previsões da ONU, é provável que em 2025 o nível de consumo eleve-se para 5200 km³. A despeito dessa elevação da utilização da água, registra-se também o aumento do número de pessoas sem fácil acesso à água potável, totalizando 1,1 bilhão em todo o planeta a sofrer com esse problema.
Além da utilização exagerada na área doméstica e no plano individual, soma-se o intensivo consumo de água nas atividades econômicas, notadamente a agricultura e a indústria, isso sem contar o grande volume desperdiçado. Não por acaso, a maior parte do consumo mundial de água acontece nos países desenvolvidos. Os emergentes ou subdesenvolvidos consomem em menor quantidade em razão do menor acesso à água e da menor intensidade das práticas econômicas. Segundo a ONU, o consumo dos países centrais é seis vezes maior do que o consumo dos países periféricos.
Fonte: http://brasilescola.uol.com.br/geografia/consumo-agua-no-mundo.htm

