Questões de Vestibular de Química - Teoria Atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica
Foram encontradas 56 questões
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
Recentemente, cientistas conseguiram produzir hidrogênio metálico, comprimindo hidrogênio molecular sob elevada pressão. As propriedades metálicas desse elemento são as mesmas dos demais elementos do grupo 1 da tabela de classificação periódica.
Essa semelhança está relacionada com o subnível mais energético desses elementos, que corresponde a:
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
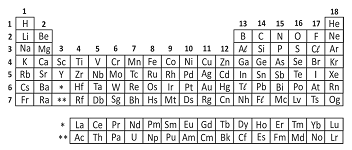
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3


Considere as seguintes afirmações:
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
É correto o que se afirma apenas em
Num processo de fissão nuclear, um nêutron colidiu com o núcleo de um isótopo do urânio levando à formação de dois núcleos menores e liberação de nêutrons que produziram reações em cadeia com liberação de grande quantidade de energia. Uma das possíveis reações nucleares nesse processo é representada por:
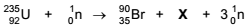
O produto X, formado na fissão nuclear indicada acima, é
um isótopo do elemento químico:
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Uma das substâncias aglutinadoras que pode ser utilizada para a nucleação artificial de nuvens é o sal iodeto de prata, de fórmula AgI. Utilizando os dados fornecidos na Classificação Periódica dos Elementos, é correto afirmar que o cátion e o ânion do iodeto de prata possuem, respectivamente,
“No verão de 1774, Joseph Priestley, na Inglaterra, descobriu que quando se aquecia cal de mercúrio (óxido de mercúrio) ao rubro, dela desprendia um “ar” que, surpreendentemente, parecia ainda mais forte ou mais puro do que o ar comum. [...] Fascinado, Priestley investigou mais a fundo, descobrindo que camundongos podiam viver naquele ar ar por um tempo quatro vezes maior do que o ar comum. E assim, convencido de que aquele “novo” ar era benigno, ele próprio o experimentou.”
SACHS, Oliver. Tio Tungstênio. São Paulo: Companhia das Letras, 2002. P. 114.
O “novo ar” de que trata o texto é constituído essencialmente do elemento químico que
O símbolo do elemento químico cuja massa é cerca de metade da massa desse bóson é:
A relação entre essas energias é dada por:

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.

Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
Na < K < Ca < Cu < Sr < Ba.


