Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.
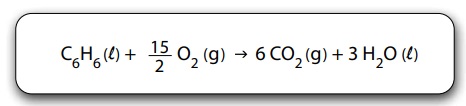
A entalpia de combustão do benzeno pode ser determinada conhecendo-se os valores das entalpias de formação do gás carbônico, assim como da água e do benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de algumas substâncias nas condições padrão.
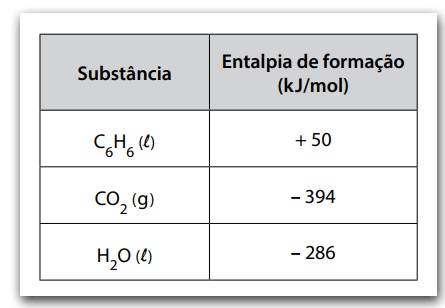
A entalpia de combustão completa do benzeno, em kJ/mol, é
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Este composto também pode ser preparado a partir de uma reação de esterificação:
CH3 –CH2 –OH (l) + CH3 –COOH (l) CH3 ⇌ COOCH2 –CH3 (l) + H2O (l)
Para calcularmos a variação de entalpia da reação, ∆H, podemos aplicar a lei de Hess às equações de combustão dos compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
I. CH3–CH2 –OH (l) + 3 O2 (g) ⇾ 2 CO2 (g) + 3 H2O (l) ∆H = – 1 368 kJ II. CH3COOH (l) + 2 O2 (g) ⇾ 2 CO2 (g) + 2 H2O (l) ∆H = – 875 kJ III. CH3COOCH2CH3 (l) + 5 O2 (g) ⇾ 4 CO2 (g) + 4 H2O (l) ∆H = – 2 231 kJ
Aplicando a lei mencionada, a variação de entalpia da reação de esterificação descrita será, em kJ, igual a
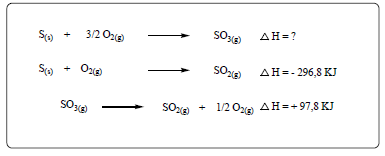
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
C3H5(NO3)3(l) → N2(g) + O2(g) + CO2(g) + H2O(g) (não balanceada)
Dados: ∆Hf C3H5(NO3)3(l) = -364 kJ/mol; ∆Hf CO2(g) = -393 kJ/mol; ∆Hf H2O(g)= -242 kJ/mol
De posse das informações, assinale a alternativa que representa a variação de entalpia da reação acima, em kJ por mol de nitroglicerina.