Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
4NH3 + 3O2 → 2N2 + 6H2O ΔH1 = –1268 kJ (Reação 1)
Entretanto, a adoção da amônia encontra vários obstáculos técnicos, como o fato de sua combustão também produzir óxidos de nitrogênio altamente tóxicos. A produção do óxido de nitrogênio mais simples (NO) é mostrada na Reação 2:
4NH3 + 5O2 → 4NO + 6H2O ΔH2 = –904 kJ (Reação 2)
Por outro lado, o óxido de nitrogênio é produzido por qualquer motor de combustão interna a partir do nitrogênio atmosférico, como mostra a Reação 3:
N2 + O2 → 2NO ΔH3 = ? (Reação 3)
Utilizando os dados fornecidos, assinale a alternativa que apresenta corretamente o valor da variação da entalpia da Reação 3 (ΔH3), em kJ.

I. A variação da entalpia pode ser calculada da seguinte forma: ΔH = Hfinal ‒ Hinicial.
II. Na aplicação da Lei de Hess, ao inverter uma reação química, o sinal de ΔH deve permanecer.
III. Ao calcular a variação de entalpia de uma reação química a partir de suas etapas e suas variações de entalpia, a reação inicial é o que predomina nesse cálculo.
IV. De uma forma geral, o cálculo do ΔH de uma reação independe do número de etapas e do tipo de reação química.
Está correto somente o que se afirma em
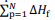 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 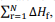 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.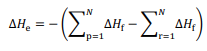
Assumindo-se que a temperatura do meio reacional aumente 25 °C com a explosão, que a pressão seja constante e que o rendimento da reação tenha sido de 100%, conclui-se que o volume total de gases produzidos na decomposição do RDX será inferior a 0,95 L por grama de explosivo.
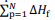 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 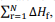 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.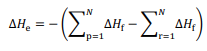

Considere que a entalpia de formação (ΔHf) do RDX seja +83,82 kJ/mol e que os valores de ΔHf para CO, H2O e N2 sejam, respectivamente, −111,8 kJ/mol, −240,6 kJ/mol e 0,0 kJ/mol. Nessas condições, o calor liberado pela detonação de 1 kg de RDX será inferior a 5.000 kJ.

A entalpia de vaporização caracteriza-se por ser sempre positiva.

A entalpia de um sistema é uma grandeza, expressa em unidade de energia, que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo a pressão constante.

A reação de combustão do gás hidrogênio gera água na forma de vapor; se a reação gerasse água na forma líquida, a liberação de energia seria a mesma.

Reações de combustão são facilmente reversíveis.

A entalpia-padrão de formação (ΔHºf) é nula para substâncias simples, desde que estejam no estado-padrão, no estado físico e na forma alotrópica mais estáveis.

A reação de combustão do gás hidrogênio libera uma quantidade de energia superior a 230 kJ/mol.

A entalpia-padrão de combustão (ΔHºc) pode ser chamada, também, de calor de combustão.
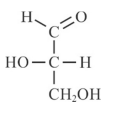
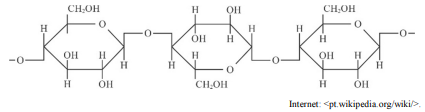
Com base nas informações do texto antecedente, julgue o item.
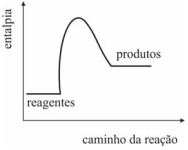
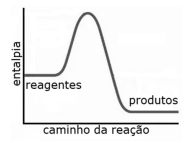
O gráfico a seguir representa corretamente a variação de entalpia da reação da fotossíntese ao longo da reação.
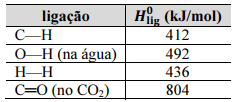
Considerando-se que os valores de Ho lig apresentados são válidos para as condições em que a reforma a vapor do metano esteja sendo realizada, conclui-se que a entalpia padrão da reação, conforme apresentada, é superior a 300 kJ/mol.
A partir do texto precedente e considerando que as entalpias de combustão do metano e do 2,2,4-trimetilpentano sejam respectivamente iguais a 890 kJ/mol e 5.464 kJ/mol, julgue o item subsequente.
A eventual substituição do 2,2,4-trimetilpentano por metano como combustível, admitindo-se combustão completa, permitiria uma redução superior a 20% na quantidade de CO2 liberada para a mesma quantidade de energia gerada.
Considere a seguinte reação reversível genérica:
A + B ⇌ C + D
O gráfico termoquímico para essa reação está demonstrado na figura a seguir.
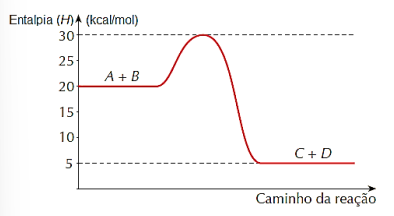
De acordo com os dados do gráfico, assinale
a alternativa correta.
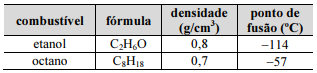
Maior causador do efeito estufa, o CO2 é liberado pela queima de combustíveis como o octano, um dos principais componentes da gasolina, e o etanol, obtido de biomassa. A esse respeito e considerando os dados na tabela precedente, julgue os item.
Considerando a combustão total, assinale a opção que representa corretamente os volumes dos combustíveis octano (à esquerda) e etanol (à direita) que devem ser queimados para que haja emissão de uma quantidade equivalente de CO2 pelos dois compostos.
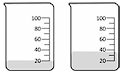
Tendo como referência as informações precedentes, julgue o item que se segue.
O valor da variação de entalpia molar da reação em relação
à hematita, que reage com o monóxido de carbono,
produzindo apenas ferro metálico e dióxido de carbono, é
3 ΔHI + 2 ΔHII +ΔHIII.
LIGAÇÃO ENERGIA DE LIGAÇÃO (kJ/mol) C—H 410
Cl—Cl 240
C—Cl 330
H—Cl 430
A energia, em quilojoules, liberada na formação de 1,0 mol de diclorometano é igual a:
O gráfico a seguir representa corretamente a reação de combustão da madeira usada na queima da argila para a formação da cerâmica.