Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
Considere a reação de hidrogenação do ciclopenteno, em fase gasosa, formando ciclopentano, e a tabela de entalpias de ligação, mostradas abaixo.
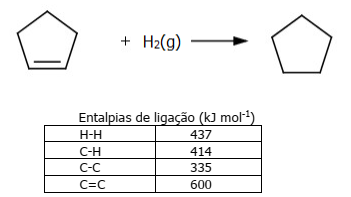
Qual será o valor da entalpia da reação de hidrogenação do ciclopenteno em kJ/mol?
Duas reações químicas envolvendo o gás metano, juntamente com o seu efeito térmico, são equacionadas abaixo.
C(graf) + 2 H2 (g) → CH4 (g) ΔHI
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) ΔHII
Considere as seguintes afirmações a respeito das reações químicas.
I - ΔHI é um exemplo de entalpia de ligação.
II - ΔHII é um exemplo de entalpia de combustão.
III- ΔHII é negativo.
Quais estão corretas?
Cgraf + O2(g) → CO2(g)
 = -393,3 kJ Cdiam + O2(g) → CO2(g)
= -393,3 kJ Cdiam + O2(g) → CO2(g)  = -395,2 kJ Cgraf → Cdiam
= -395,2 kJ Cgraf → Cdiam  = ?
= ? A partir dos valores de entalpia de formação do CO2, qual é a entalpia de reação para a transformação do carbono grafite em carbono diamante?
HCl(aq) + NH3(aq) → NH4Cl(s)
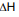 = ???
= ??? A partir dos valores das entalpias de formação do HCl (
 = -46 kJ.mol-1), NH3 (
= -46 kJ.mol-1), NH3 ( = -92 kJ.mol-1) e NH4Cl (
= -92 kJ.mol-1) e NH4Cl ( = -314 kJ.mol-1), determine a variação de entalpia
(
= -314 kJ.mol-1), determine a variação de entalpia
(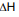 ) da reação acima e se o processo é endotérmico
ou exotérmico.
) da reação acima e se o processo é endotérmico
ou exotérmico. 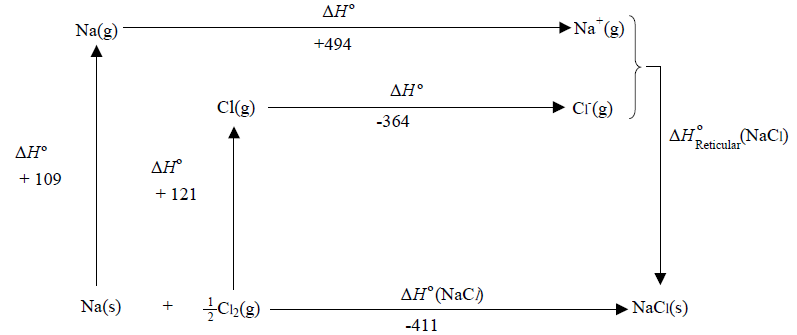
Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para
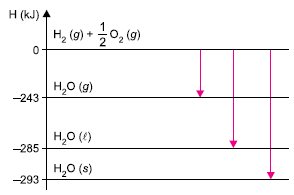
Esses dados permitem verificar que o calor de vaporização da água sólida é igual a
Tal como a gasolina que explode nos cilindros de um motor de carro, a glicose é o combustível “queimado” no interior das células para a liberação da energia necessária às suas diversas atividades.
Em relação aos processos de obtenção de energia, pode-se afirmar:
Considere as reações 1 e 2 abaixo:
(Reação 1) 6 CO2 + 6 H2O + Energia → C6 H12O6 + 6 O2
(Reação 2) C6 H12O6 + 6 O2 → 6 CO2 + 6 H2 O + Energia
Com relação às reações apresentadas, é INCORRETO afirmar que
A maior parte da energia de que o nosso corpo necessita vem da combustão de carboidratos por meio da respiração celular. O corpo utiliza a energia para contrair os músculos, construir e reparar os tecidos e manter a temperatura corporal. O excesso é armazenado como gordura, reserva de energia para o corpo. A composição de óleos e gorduras, de origem animal ou vegetal, comumente indicados nas embalagens dos alimentos, é expressa como “gorduras”. Um tipo de óleo vegetal geralmente usado pela população é o óleo de soja. Considere a fórmula do óleo de soja como sendo C56H100O6 (massa molar = 868 g/mol) e os dados da tabela a seguir:
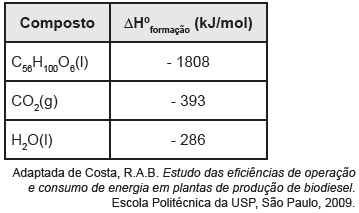
A partir dos dados, conclui-se que a energia liberada
na combustão completa de 1g do referido óleo de soja
é de aproximadamente
A propriedade física da água relacionada a esse fenômeno é o(a)
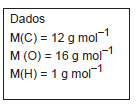
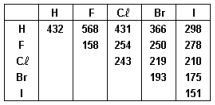
O cloreto de hidrogênio é um gás que, quando borbulhado em água, resulta numa solução de ácido clorídrico. Esse composto é um dos ácidos mais utilizados nas indústrias e laboratórios químicos. A energia para formação de 2 mol de cloreto de hidrogênio, em kJ, a partir de seus elementos é igual a:
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
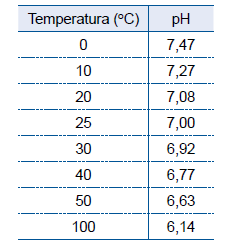
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por:
Os valores das entalpias-padrão de formação, como os apresentados na tabela, podem ser utilizados para prever a variação de entalpia associada a uma reação química, a exemplo da desidratação intramolecular do etanol, na presença do ácido sulfúrico, que leva à formação do eteno e da água, de acordo com a reação representada pela equação química
C2H6O(ℓ) → C2H4(g) + H2O(ℓ)
Considerando-se essas informações e os valores das entalpias-padrão de formação do eteno, do etanol e da água, relacionados na tabela, é correto afirmar:
Dado: massa molecular do metano = 16 g.mol-1.

A Termoquímica é a área da química que estuda as reações químicas e os fenômenos físicos em que ocorrem absorção ou liberação de energia na forma de calor.
Assim, é incorreto afirmar que a entalpia de uma reação é afetada pelo(a):H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25ºC:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔHº = -183,3 kJmol-1 Equação 2 II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔHº = - 82,4 kJmol-1 Equação 3 III - CO2(g) + H2O(l) → H2CO3(aq) ΔHº = - 20,5 kJmol-1 Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
O nitrato de potássio é um composto químico sólido, bastante solúvel em água, muito utilizado em explosivos, estando presente na composição da pólvora, por exemplo. Uma equação termoquímica balanceada para a queima da pólvora é representada abaixo:
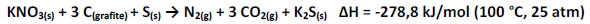
Assinale a alternativa que representa a interpretação correta da equação termoquímica para a queima da pólvora:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25oC:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1 Equação 2 II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1 Equação 3 III - CO2 (g) + H2O(l) → H2CO3(aq) ΔH° = - 20,5 kJmol-1 Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
H(g) + Cl(g) - 431.Kj → HCl(g) Hidrogênio
 Cloro
Cloro  Cloreto de Hidrogênio
Cloreto de Hidrogênio 

Em relação às combinações do hidrogênio com o cloro, é CORRETO afirmar que:


