Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 340 questões
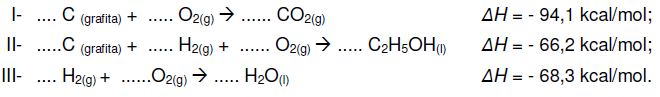
Sabendo-se que a variação de entalpia (∆H) de uma reação qualquer depende somente dos estados iniciais dos reagentes e do estado final dos produtos, marque a alternativa que corresponde aos coeficientes mínimos para a correta estequiometria das reações I, II e III, assim como a quantidade de calor produzida na combustão de 9,2 kg de álcool etílico líquido produzido [C2H5OH(l)], a partir dos coeficientes mínimos encontrados.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.
CaCℓ2 (s) + H2O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
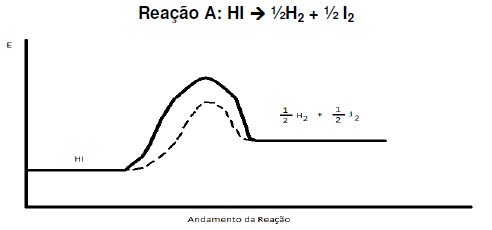
Marque a opção correta:
Observe a equação de formação de etanol a seguir:
2 Cgraf + 3 H2(g) + ½ O2(g) → C2 H6 O(l)
Com base nas equações abaixo que resultam na reação de interesse, calcule o ∆H da reação de formação do etanol.
I. Cgraf + O2(g) → CO2(g) ∆H = -394 kJ/mol
II. H2(g) + ½ O2(g) → H2 O(l) ∆H = -286 kJ/mol
III. C2
H6
O(l) + 3 O2(g) → 2 CO2(g) + 3 H2
O(l) ∆H = -1368 kJ/mol
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
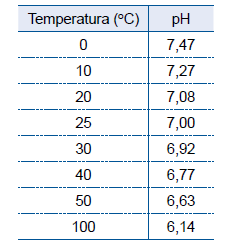
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por:
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
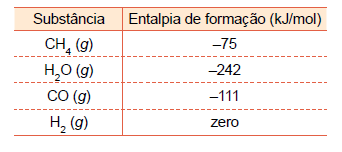
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
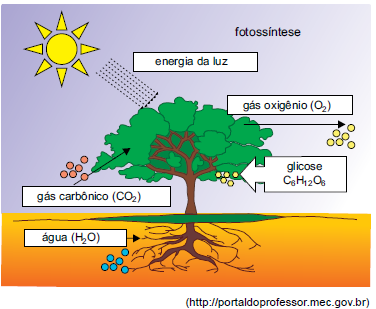
É correto afirmar que a fotossíntese é uma reação
Os valores das entalpias-padrão de formação, como os apresentados na tabela, podem ser utilizados para prever a variação de entalpia associada a uma reação química, a exemplo da desidratação intramolecular do etanol, na presença do ácido sulfúrico, que leva à formação do eteno e da água, de acordo com a reação representada pela equação química
C2H6O(ℓ) → C2H4(g) + H2O(ℓ)
Considerando-se essas informações e os valores das entalpias-padrão de formação do eteno, do etanol e da água, relacionados na tabela, é correto afirmar:
2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H6O(l) ΔHf = ?
Energeticamente, a entalpia padrão de formação do etanol pode ser determinada através de 3 diferentes equações de combustão. As equações estão representadas abaixo:
C(graf) + O2(g) → CO2(g) ΔHf = -394 kJ mol-1
H2(g) + 1/2 O2(g) → H2O(l) ΔHf = -286 kJ mol-1
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) ΔHf = -1368 kJ mol-1
Baseado nos dados acima, qual o ΔHf do etanol, em kJ.mol-1?
Al2O3(s) + 3 C(s) → 2 Al(l) + 3 CO(g)
O processo de extração demanda um custo energético de aproximadamente 600 kJ para a obtenção de 54 g de alumínio, enquanto para a mesma massa através da reciclagem são utilizados 50 kJ de energia. Quanto é economizado de energia, para cada 108 kg do alumínio reciclado em relação ao material extraído da bauxita, em 106 kJ?
Dados: Massas atômica em g·mol-1 : Al = 27.
Sabendo que a reação de combustão da glicina é representada pela equação química:
4 C2H5NO2(s) + 9 O2(g) → 8 CO2(g) + 10 H2O(g) + 2 N2(g)
calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação listadas na Tabela 1.
Tabela 1. Entalpias-padrão de formação, ∆Hf°, a 298 K.
Substância C2H5NO2(s) CO2(g) H2O(l)
∆Hf°(kJ/mol) −533,0 −394 −286
C6H12O6(s) → 2 C2H5OH(l) + 2 CO2(g) ∆H°= −74,0 kJ.mol−1
Calcule a quantidade de glicose, em gramas, a ser fermentada para produzir 300 kJ de calor.
Dados: Massas molares em g.mol−1: H = 1; C = 12; O = 16.
Dado: massa molecular do metano = 16 g.mol-1.