Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 346 questões
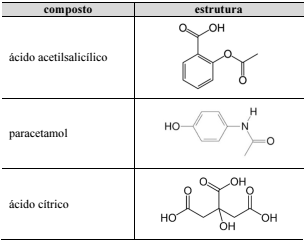
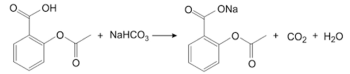
Os compostos orgânicos listados na tabela precedente são amplamente utilizados em medicamentos, entre os quais estão incluídos os efervescentes. Estes resultam da combinação de sólidos misturados e prensados para formar um comprimido contendo o fármaco ácido e um composto básico, como o NaHCO3. Quando o medicamento é colocado na água, a reação entre esses compostos libera CO2, que forma as bolhas na efervescência, como representado para o ácido acetilsalicílico na reação a seguir. Existem, também, vários compostos inorgânicos que são empregados na fabricação de medicamentos, como o FeSO4 e o KMnO4.
Tendo como referência as informações precedentes, julgue o item.
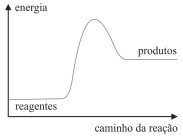
Sabendo que o KMnO4 reage com a glicerina em uma reação que libera bastante calor, é correto concluir que a variação de energia para essa reação pode ser corretamente representada pelo gráfico a seguir.
O fenômeno climático das monções, que ocorre na Ásia, propicia a dispersão de poluentes que formam particulados, como o sulfato de amônio [(NH4)2SO4]. Esse composto é formado na atmosfera pela reação da amônia (NH3) com o dióxido de enxofre (SO2), de acordo com as equações:
SO2 (g)+ 1/2O2(g) → SO3 (g)
H2O (ℓ)+SO3(g) → H2SO4 (ℓ)
2NH3 (g) + H2SO4 (ℓ) → (NH4)2SO4 (s)
Considere os valores de entalpia-padrão de formação:
SO2 (g) 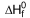 = -298 kJ/mol
= -298 kJ/mol
NH3 (g) 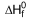 = -46 kJlmol
= -46 kJlmol
H2O (ℓ) 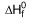 = -286 kJ/mol
= -286 kJ/mol
(NH4)2SO4 (s) 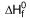 = -1179 kJ/mol
= -1179 kJ/mol
Com base nas informações apresentadas, pode-se afirmar
que a entalpia-padrão de reação de formação de 1 mol de
sulfato de amônio é
Oxigênio (O2) e ozônio (O3) estão em constante processo de consumo e produção na estratosfera, como representado pelas equações químicas a seguir. As reações I e II ilustram etapas da produção de ozônio a partir de oxigênio, e a reação III mostra a restauração de oxigênio a partir de ozônio.
Reação ΔH (kcal/mol de O2)
I O2 → 2 O. −118
II 2 O2 + 2 O. → 2 O3 ΔHII
III 2 O3 → 3 O2 +21
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Atente para as informações contidas na seguinte tabela:
Substância Calor de combustão (kcal/mol)
Carbono 1.646,92
Metano 3.720,20
Butano 12.038,40
Octano 22.822,80
De acordo com as informações da tabela acima, o
combustível capaz de produzir a maior quantidade de
calor por quilograma queimado é o
Substância Entalpia de formação (kcal/mol) CO2 −95,0 CO −25,0
Com base nessas informações e nos conhecimentos sobre termoquímica, assinale a alternativa que apresenta, corretamente, a entalpia da reação C(s) + CO2(g) → 2CO(g).
Cgraf + O2(g) → CO2(g)
 = -393,3 kJ Cdiam + O2(g) → CO2(g)
= -393,3 kJ Cdiam + O2(g) → CO2(g)  = -395,2 kJ Cgraf → Cdiam
= -395,2 kJ Cgraf → Cdiam  = ?
= ? A partir dos valores de entalpia de formação do CO2, qual é a entalpia de reação para a transformação do carbono grafite em carbono diamante?
HCl(aq) + NH3(aq) → NH4Cl(s)
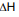 = ???
= ??? A partir dos valores das entalpias de formação do HCl (
 = -46 kJ.mol-1), NH3 (
= -46 kJ.mol-1), NH3 ( = -92 kJ.mol-1) e NH4Cl (
= -92 kJ.mol-1) e NH4Cl ( = -314 kJ.mol-1), determine a variação de entalpia
(
= -314 kJ.mol-1), determine a variação de entalpia
(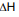 ) da reação acima e se o processo é endotérmico
ou exotérmico.
) da reação acima e se o processo é endotérmico
ou exotérmico. Considere o ciclo para o NaCl na figura a seguir:
A representação CORRETA de um dos processos que ocorrem nesse ciclo é:
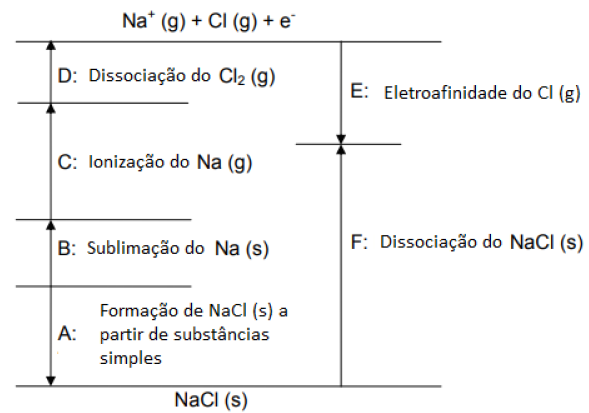
A energia envolvida na formação do gás metano a partir de gás carbônico e água é:
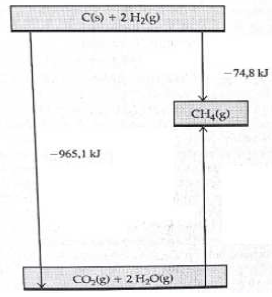
Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para

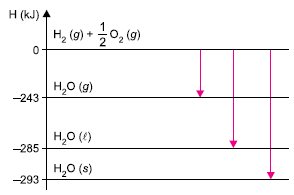
Esses dados permitem verificar que o calor de vaporização da água sólida é igual a
ΔH de formação do CO2 = - 94,1 kcal ΔH de formação do H2O = - 68,3 kcal ΔH de formação do etanol (C2H6O) = - 66,1 kcal.
A quantidade de calor (em kcal) desprendida na reação de combustão completa de 0,5 mol de etanol (C2H6O), é:
C6H12O6
 2 C2H5OH + 2 CO2
2 C2H5OH + 2 CO2 Sendo os calores de formação da glicose, do gás carbônico e do álcool, respectivamente, –302, –94 e –66 kcal/mol, pode-se afirmar que a fermentação ocorre com:
2 C (s) + 3 H2 (g) + ½ 02 (g) --+ C2HsOH (1)
Embora essa reação, tal como está escrita, não possa ser realizada em laboratório, pode-se calcular seu efeito térmico, mediante uma combinação adequada de outras reações.
Usando as reações abaixo,
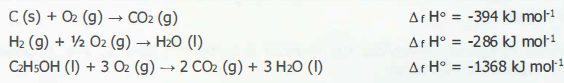
a entalpia da reação de formação do etanol, em kJ mo1-1 , é
A energia produzida, em kcal. mol-1, pela combustão completa de 1000 g de uma mistura de metano e butano na proporção em massa de 2 partes do primeiro para 3 partes do segundo, será aproximadamente
Considere a combustão completa de etanol suficiente para gerar um calor de 1.105 kJ.

Com base na entalpia de formação aproximada dos compostos dados na tabela, a massa de gás carbônico, em kg, liberada nessa queima é de, aproximadamente:
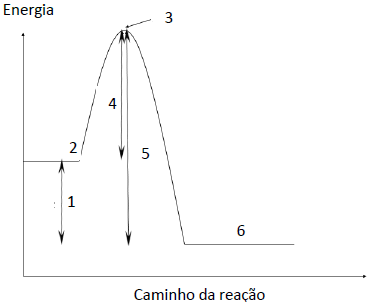
Energia de ativação, variação de entalpia da transformação e complexo ativado podem ser, respectivamente, associados aos números
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
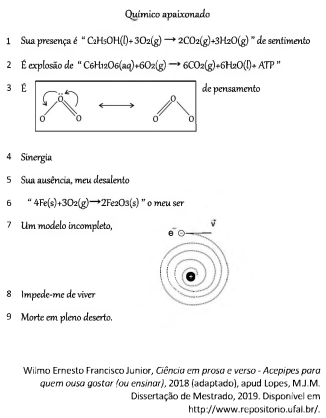
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):



