Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
Considerando essa informação, pode-se concluir:
CaCℓ2 (s) + H2O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
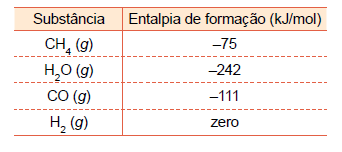
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano
2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H6O(l) ΔHf = ?
Energeticamente, a entalpia padrão de formação do etanol pode ser determinada através de 3 diferentes equações de combustão. As equações estão representadas abaixo:
C(graf) + O2(g) → CO2(g) ΔHf = -394 kJ mol-1
H2(g) + 1/2 O2(g) → H2O(l) ΔHf = -286 kJ mol-1
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) ΔHf = -1368 kJ mol-1
Baseado nos dados acima, qual o ΔHf do etanol, em kJ.mol-1?
Al2O3(s) + 3 C(s) → 2 Al(l) + 3 CO(g)
O processo de extração demanda um custo energético de aproximadamente 600 kJ para a obtenção de 54 g de alumínio, enquanto para a mesma massa através da reciclagem são utilizados 50 kJ de energia. Quanto é economizado de energia, para cada 108 kg do alumínio reciclado em relação ao material extraído da bauxita, em 106 kJ?
Dados: Massas atômica em g·mol-1 : Al = 27.
I. H2(g) + O2(g) ⇾ H2O(l) ΔH = -68 Kcal/mol II. C(g) + O2(g) ⇾ CO2(g) ΔH = -94 Kcal/mol III.C2H5OH(l) + O2(g) ⇾ CO2(g) + H2O(l) ΔH = -327 Kcal/mol
A entalpia de formação do etanol será:
MgO + H2O → Mg(OH)2 + X kcal/mol
Sabendo-se que as entalpias de formação dos compostos envolvidos são a 1atm e 25ºC (condições-padrão):
∆H (MgO) = -152 kcal/mol; ∆H (H2 O) = -68 kcal/mol; ∆H (Mg(OH)2 ) = -240 kcal/mol;
Em relação à reação e o calor envolvido no processo, assinale a alternativa CORRETA.
C(graf) + 2H2(g) → CH4(g)
As reações envolvidas neste processo encontram-se representadas da seguinte forma:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆H° = -890,4 kJ/mol C(graf) + O2(g) → CO2(g) ∆H° = -393,5 kJ/mol H2(g) + 1 O2(g)/2 → H2O(l) ∆H° =- 285,8 kJ/mol
Com base nessas reações, verifica-se que o valor da entalpia padrão de formação do CH4(g) é:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas. (www.osorio.rs.gov.br. Adaptado.)
Considere agora a combustão completa do metano, principal componente do gás natural, cuja entalpia de combustão completa é cerca de – 9 × 102 kJ/mol, e que as transformações de energia nessa combustão tenham eficiência ideal, de 100%.
Para fornecer a mesma quantidade de energia obtida pelo Parque Eólico de Osório quando opera por 1 hora com sua capacidade máxima, uma usina termoelétrica a gás necessitaria da combustão completa de uma massa mínima de metano da ordem de
Considere que a massa molar do principal componente do biogás é 16 g/mol e que sua combustão completa produz 802 kJ/mol, nas condições experimentais. A quantidade de energia gerada ao final de um dia, em que houve a formação de 1 kg desse componente do biogás é
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
A equação química que representa a reação que ocorre na fermentação alcoólica da glicose é
C6H12O6(aq) → 2 C2H6O(aq) + 2 CO2(g) ΔrH = ?
Assinale a alternativa que apresenta o valor correto da entalpia padrão da reação (ΔrH) de fermentação da glicose, em kJ/mol.
Entalpias de formação em kJ/mol
Substância ΔfH C6H12O6(aq) – 1 277 C2H6O (aq) – 278 CO2(g) – 394

