Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 340 questões
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas. Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por exemplo, o cloreto de cálcio (CaCℓ2 ). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve, conforme a reação representada pela equação:
CaCℓ2 (s) + H2 O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
I. H2(g) + O2(g) ⇾ H2O(l) ΔH = -68 Kcal/mol II. C(g) + O2(g) ⇾ CO2(g) ΔH = -94 Kcal/mol III.C2H5OH(l) + O2(g) ⇾ CO2(g) + H2O(l) ΔH = -327 Kcal/mol
A entalpia de formação do etanol será:
Durante a última parte da viagem, Eduardo pega um pacote contendo 40g de biscoito e lê o rótulo. A tabela que Eduardo vê foi adaptada e está representada a seguir:
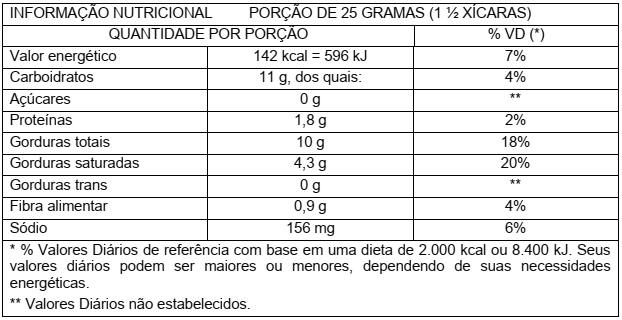
Considere que o total de gordura refere-se apenas a triglicerídeos. Com base nas informações acima, assinale a proposição CORRETA.
Segundo o rótulo do produto, seriam necessários mais de 30 pacotes de biscoito para suprir
a necessidade energética.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Em contato com a água, o sódio metálico reage gerando um forte aquecimento, fenômeno
típico de uma reação endotérmica.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

O fato da reação apresentar ∆H<0 indica que a velocidade de obtenção do CH3CH2Br é alta.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O valor de ∆H sugere que a reação é endotérmica.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.

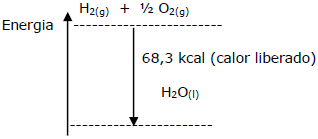
Com relação a esse processo, assinale a equação química correta.
MgO + H2O → Mg(OH)2 + X kcal/mol
Sabendo-se que as entalpias de formação dos compostos envolvidos são a 1atm e 25ºC (condições-padrão):
∆H (MgO) = -152 kcal/mol; ∆H (H2 O) = -68 kcal/mol; ∆H (Mg(OH)2 ) = -240 kcal/mol;
Em relação à reação e o calor envolvido no processo, assinale a alternativa CORRETA.
C(graf) + 2H2(g) → CH4(g)
As reações envolvidas neste processo encontram-se representadas da seguinte forma:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆H° = -890,4 kJ/mol C(graf) + O2(g) → CO2(g) ∆H° = -393,5 kJ/mol H2(g) + 1 O2(g)/2 → H2O(l) ∆H° =- 285,8 kJ/mol
Com base nessas reações, verifica-se que o valor da entalpia padrão de formação do CH4(g) é:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:

A Termoquímica é a área da química que estuda as reações químicas e os fenômenos físicos em que ocorrem absorção ou liberação de energia na forma de calor.
Assim, é incorreto afirmar que a entalpia de uma reação é afetada pelo(a):Instrução: Leia atentamente o texto abaixo para responder a questão.


A entalpia de combustão do carbono, a 25 °C, é de 393,5 kJ.mol−1. Considerando 1,0 kg de turfa, um tipo de carvão mineral que contém somente 60% de carbono, em média, a energia liberada, em kJ, somente pela queima de carbono é de, aproximadamente,
Dado:
massa molar do C = 12 g.mol−1

8Li(s) + SF6(g) → Li2S(s) + 6LiF(s)
Com base nos conhecimentos da Química, considerando-se a tecnologia de adaptação de energia química armazenada para ogivas de torpedos, desenvolvida pela Marinha dos EUA, relacionando-a às informações do texto e à equação química, é correto concluir:
A massa de hidrogênio, em gramas, necessária para gerar a mesma quantidade de energia que a gerada por 1 g de dodecano equivale a:
Utilize as informações a seguir para responder à questão.
Cada mol de glicose metabolizado no organismo humano gera o equivalente a 3 000 kJ de
energia. A atividade da célula nervosa, em condições normais, depende do fornecimento
constante dessa fonte energética.
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
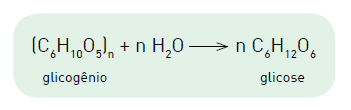
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 . A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
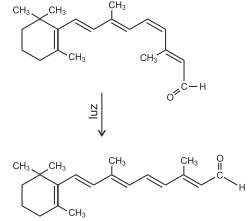
O processo de visão é iniciado na retina a partir de células fotorreceptoras que utilizam pigmentos contendo proteínas e o cis-retinal, um derivado da vitamina A, fotorreceptor. Durante o processo, o cis-retinal absorve luz e se transforma em trans-retinal, representados na equação química, gerando um impulso elétrico, que é enviado ao cérebro. O trans-retinal é reconvertido à forma cis, que absorve luz e dá continuidade ao processo.
A análise dessas informações permite concluir: