Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
N2 H4(g) + 2 H2 O2(l) → N2(g) + 4 H2O(g) ΔH = - 644,0 kJ
Com excesso de peróxido de hidrogênio e supondo 100% o rendimento da reação, é possível determinar a massa de hidrazina que, ao ser consumida, produzirá energia equivalente a 2.576 kJ. Esse valor, em gramas, é
Dados:
N - 14 u
H - 1 u
O - 16 u
NH4NO3(s)+H2O( l ) →NH4+(aq)+NO3-(aq) ΔΗ = 26 kJ mol-1 1
CaCl2(s)+H2O( l ) →Ca2+ (aq)+2Cl-(aq) ΔΗ = - 82 kJ mol-1 2
De acordo com a notação química, pode-se afirmar que as equações 1 e 2 representam processos de
C8H18 (L) + 25/2 O2(g) ➡ 8CO2(g) + 9H2O(L) Δ H0 = -5471KJ
Nestas condições, é CORRETO afirmar que a razão entre as energias gastas em um ano, nessa jornada, pelo automóvel e o estudante na bicicleta, é aproximadamente

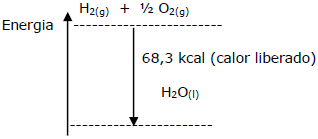
Com relação a esse processo, assinale a equação química correta.

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJDadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
A2 + B2 → 2 AB
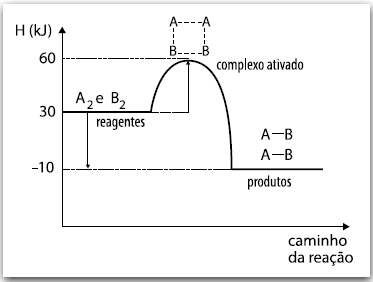
A análise do gráfico permite concluir corretamente que
Considere as reações:
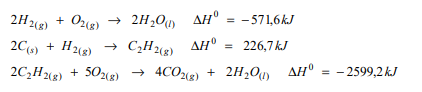
Assinale a entalpia padrão de formação do dióxido de carbono em kJ mol–1
.
Considere o diagrama energético de uma reação:
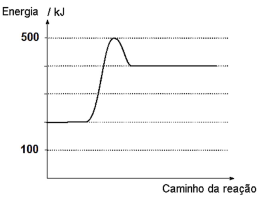
A energia de ativação e a variação de entalpia da reação são, respectivamente, iguais a:
DADOS QUE PODEM SER USADOS NESTA PROVA

I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A reação I é mais espontânea que a reação II.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A constante de equilíbrio para a reação II, a 298K, é 1,05.10–5.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A variação de entalpia para a reação II, no sentido direto, a 298K, é – 41 180Jmol–1.

As propriedades físico-químicas das substâncias são afetadas pelas interações intra e
intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
A entalpia normal de vaporização do metanol é maior que a do metano.
A decomposição de uma amostra de carbonato de cálcio consumiu 266 kJ. A partir desse resultado e da equação termoquímica abaixo, conclui-se que:
CaCO3(s) → CaO(s) + CO2(g); ΔH = +133 kJ mol-1