Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
A reação de combustão da glicose, por ser endotérmica, é um processo espontâneo.
Considere que um painel com eficiência de 50% na conversão da radiação solar em calor esteja instalado em uma região onde a quantidade de energia irradiada pelo Sol é de 334,4 kJ por minuto. Nessa situação, assumindo-se que a água tem calor específico de 4,18 J/g °C e densidade de 1g/cm³ , o tempo necessário para se elevar a temperatura de 500 L de água de 25 ºC para 45 ºC é igual a
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
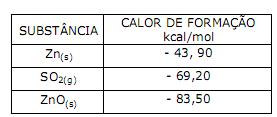
Utilizando-se os valores da tabela, o calor de combustão do sulfeto de zinco será
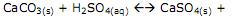
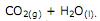 A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.
A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato. 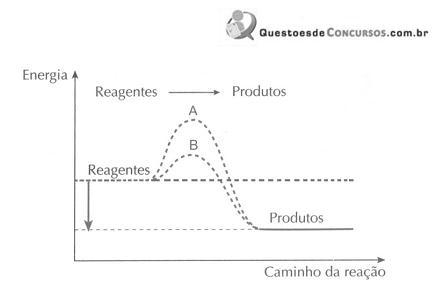
Analisando o diagrama, pode-se afirmar que:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A reação 2B2O3(S) + 2H2O(l) ==> 4HBO2(aq) é endotérmica.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A formação de 352 g de HBO2, a partir de H2B4O7 e água, produz um ∆H de -29,0 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H2B4O7(aq) + 10H2O(l) ==> 8H3BO3(aq) é igual a -10,6 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A Lei de Hess diz que a variação de entalpia em uma reação depende apenas do estado final da reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H3BO3(aq) ==> B2O3(s) + 3H2O(l) é igual a 14,0 kJ.
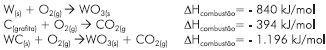

De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.