Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 348 questões
Utilize as informações a seguir para responder à questão.
Cada mol de glicose metabolizado no organismo humano gera o equivalente a 3 000 kJ de
energia. A atividade da célula nervosa, em condições normais, depende do fornecimento
constante dessa fonte energética.
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
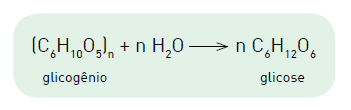
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 . A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
(I) H2O(l) → H2(g) + 1/2O2(g) ∆H = +286 kJ (II) H2(g) + ½ O2(g) → H2O(g) ∆H = - 242 kJ (III) H2O(l) → H2O(s) ∆H = - 7,3 kJ
De acordo com as equações acima e os seus conhecimentos de química, é incorreta a afirmativa:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
 O gás hilariante, N2O, age no sistema nervoso central e provoca
risos descontrolados. É um anestésico que pode causar
degeneração da coluna vertebral e perda temporária do controle
motor. Um dos métodos de obtenção desse gás é o de
decomposição térmica do nitrato de amônio, NH4NO3(s), de
acordo com a equação química
O gás hilariante, N2O, age no sistema nervoso central e provoca
risos descontrolados. É um anestésico que pode causar
degeneração da coluna vertebral e perda temporária do controle
motor. Um dos métodos de obtenção desse gás é o de
decomposição térmica do nitrato de amônio, NH4NO3(s), de
acordo com a equação química 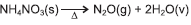 . A partir dessas informações e das entalpias das substâncias
envolvidas na equação química de decomposição do nitrato
de amônio, mostradas na tabela, é correto afirmar:
. A partir dessas informações e das entalpias das substâncias
envolvidas na equação química de decomposição do nitrato
de amônio, mostradas na tabela, é correto afirmar: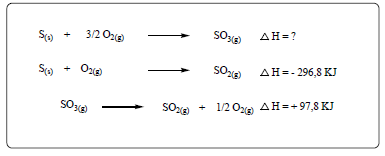
I. A combustão completa do metano (CH4 ) produzindo CO2 e H2 O.
II. O derretimento de um iceberg.
III. O impacto de um tijolo no solo ao cair de uma altura h.
Em relação aos processos analisados, pode-se afirmar que:

Essa última transformação
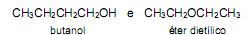
Certas propriedades de cada uma dessas substâncias dependem das interações entre as moléculas que a compõem (como, por exemplo, as ligações de hidrogênio). Assim, pode-se concluir que,
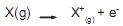
Esse é um processo endotérmico, porque o elétron é atraído pelo núcleo positivo, portanto, deve-se fornecer energia para removê-lo. Uma vez que todos os átomos, exceto o hidrogênio, possuem mais do que um elétron, eles também possuem mais de um potencial de ionização. Considerando essa informação, escolha a alternativa que apresenta o átomo com maior potencial de ionização dentre os pares abaixo:
(1) B ou C; (2) O ou Si; (3) Cl ou As.

Sobre essa reação, marque a afirmativa verdadeira.
Considere que um atleta com M kg de massa, partindo do repouso, comece a correr com aceleração constante de a m/s² ; que, enquanto corre, o atleta sofre a ação de uma força de resistência constante igual a R newtons; que toda a energia do atleta resulta da oxidação de gordura, a qual é representada pela expressão a seguir, em que E é a energia, em joules, liberada por mol de gordura.
C3H5O3(OC4H7)3 + 18,502 ? 15CO2 + 13H2O + E
Supondo-se que a eficiência do atleta seja 0, então a expressão matemática que representa a quantidade de moles N de gás carbônico produzido pelo atleta até o tempo t, em segundos, transcorrido desde o momento em que ele iniciou a corrida, é
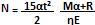
Considere que uma pessoa que pese 60 kg tenha subido, com velocidade constante, uma ladeira de 30° de inclinação, mantendo uma respiração que consome 0,78 L de O2 por minuto. Nesse caso, se toda a produção de energia interna vier da oxidação de glicose, então essa pessoa terá caminhado, em uma hora, menos de 3,5 km.
A reação de combustão da glicose, por ser endotérmica, é um processo espontâneo.
Considere que um painel com eficiência de 50% na conversão da radiação solar em calor esteja instalado em uma região onde a quantidade de energia irradiada pelo Sol é de 334,4 kJ por minuto. Nessa situação, assumindo-se que a água tem calor específico de 4,18 J/g °C e densidade de 1g/cm³ , o tempo necessário para se elevar a temperatura de 500 L de água de 25 ºC para 45 ºC é igual a


