Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
Analise os processos a seguir:
I. oxidação de nitrogênio: N2(g) + 2O2(g) →2NO2(g)
II. fotossíntese da glicose: 6CO2(g) + 6H2O(g) → C6H12O6(s) + 6O2(g)
III. evaporação da água de roupas úmidas
IV. dissolução do sal: KNO3(s) → K+ (aq) + NO3 - (aq)
Ocorre aumento de entropia durante os processos
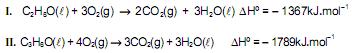
Os processos de combustão do etanol,
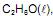 utilizado como combustível em veículos, e da propanona,
utilizado como combustível em veículos, e da propanona, 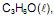 solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II.
solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II. Considerando-se essas informações e a densidade do etanol igual a 0,8g.mL, é correto concluir:
saponificação dos óleos vegetais são utilizados como sabões.
Entretanto, em regiões cujas águas são ricas em metais
alcalinoterrosos (chamadas águas duras), principalmente Ca2+ eMg 2+
, os sabões perdem eficiência devido à baixa solubilidade dos
sais orgânicos desses metais, o que causa a precipitação.
Com base nessas informações e considerando as soluções ideais,
julgue os itens 148 e 149 e assinale a opção correta no item 150, que
é do tipo C.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
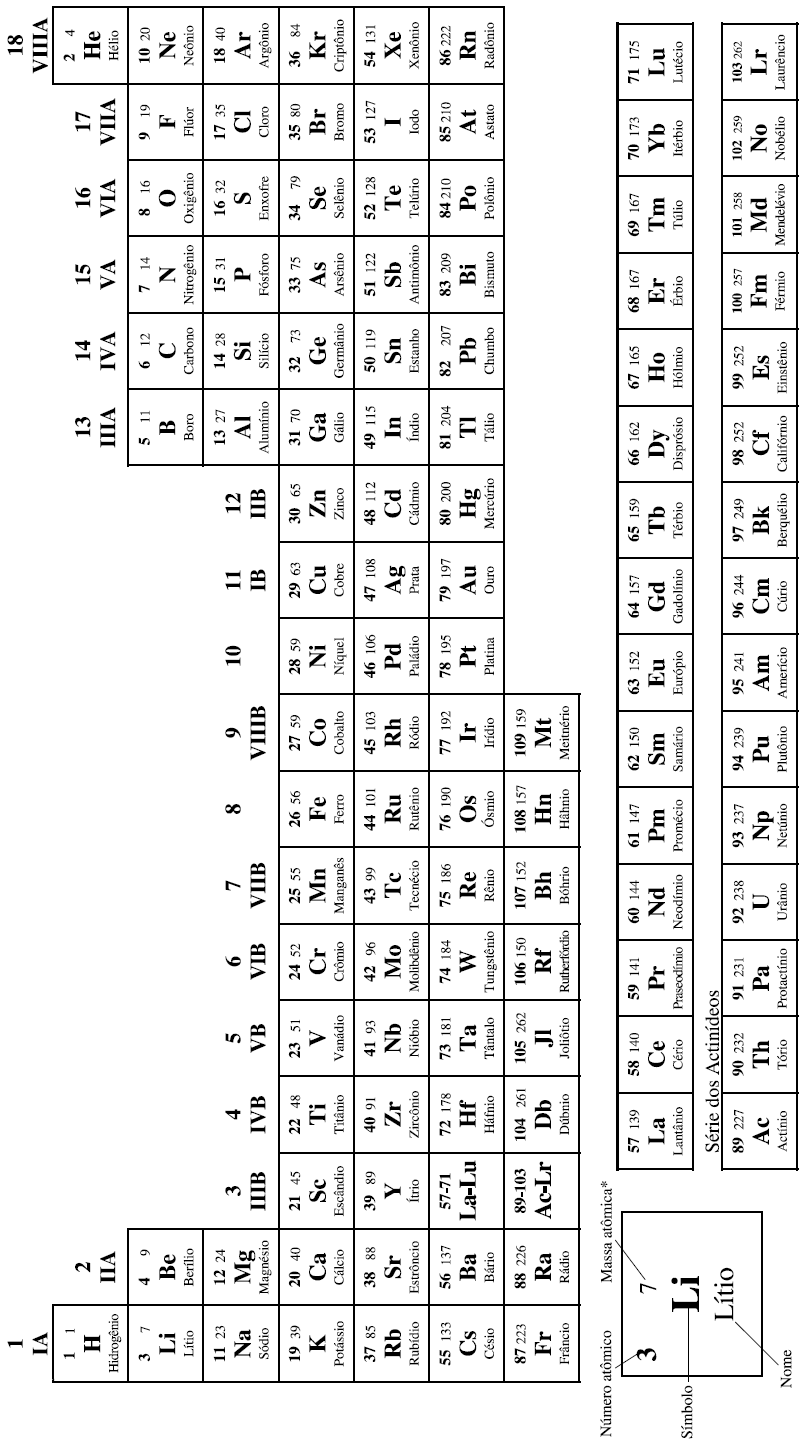
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
A lei de Dulong-Petit, segundo a qual, a altas temperaturas, o calor específico de um sólido a volume constante deve ser igual a 3R, em que R é a constante dos gases, pode ser aplicada ao CO2.
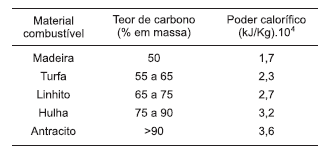
O carvão mineral é o mais abundante combustível fóssil existente na natureza. Ele é utilizado como fonte de energia desde a antiguidade e sua comercialização vem desde o Império Romano. A origem desse mineral remonta há cerca de 300 milhões de anos, no período Carbonífero, quando grande quantidade de biomassa, coberta por águas estagnadas, foi transformada em turfa, e, em seguida, em carvão. A hulha é um dos materiais carboníferos de grande importância econômica porque é uma fonte de hidrocarbonetos aromáticos, de gases combustíveis e de coque, resíduo utilizado em siderúrgicas. No Brasil, em Charqueadas, município do Rio Grande do Sul, encontra-se uma das minas de subsolo do Estado com 90% das reservas de carvão mineral do país.
A partir das informações do texto, da tabela que representa o teor de carbono de algumas espécies carboníferas e dos dados da tabela, é correto afirmar:

Habitantes de uma região do Cerrado deixaram de utilizar GLP para a produção de energia de uso doméstico e passaram a produzir e a usar o biogás, combustível rico em metano, obtido a partir da fermentação anaeróbica de restos de biomassa e de dejetos de bovinos e de suínos. A preferência pelo biogás em lugar do gás liquefeito de petróleo, GLP, que contém propano e butano, se deu por razões de economia de energia.
Considerando-se essas informações, é correto afirmar:
Um professor realizou um experimento em um laboratório no qual ele realizou a queima de papel amassado e de esponja de aço, respectivamente, em balanças artesanais, conforme figura 1.

I - Em ambas as combustões (queima do papel e queima da esponja de aço) são produzidos gás carbônico e Água.
II - A combustão da esponja de aço tem como produtos óxidos de Ferro.
III - A combustão do papel tem como produtos água e outros materiais.
Está(ão) correta(s) a(s) afirmativa(s):
Considere a reação de combustão de 1,0 mol de eteno (C2H4), a 25 o C e 1,0 atm, conforme a equação a seguir:
(Dado: volume molar nas CNTP = 22,4 L)

Considere a reação de combustão de 1,0 mol de eteno (C2H4), a 25 o C e 1,0 atm, conforme a equação a seguir:
(Dado: volume molar nas CNTP = 22,4 L)

Considere a reação de combustão de 1,0 mol de eteno (C2H4), a 25 o C e 1,0 atm, conforme a equação a seguir:
(Dado: volume molar nas CNTP = 22,4 L)

Considere a reação de combustão de 1,0 mol de eteno (C2H4), a 25 o C e 1,0 atm, conforme a equação a seguir:
(Dado: volume molar nas CNTP = 22,4 L)

Considere a reação de combustão de 1,0 mol de eteno (C2H4), a 25 o C e 1,0 atm, conforme a equação a seguir:
(Dado: volume molar nas CNTP = 22,4 L)
Marque a opção correta:
Durante a última parte da viagem, Eduardo pega um pacote contendo 40g de biscoito e lê o rótulo. A tabela que Eduardo vê foi adaptada e está representada a seguir:
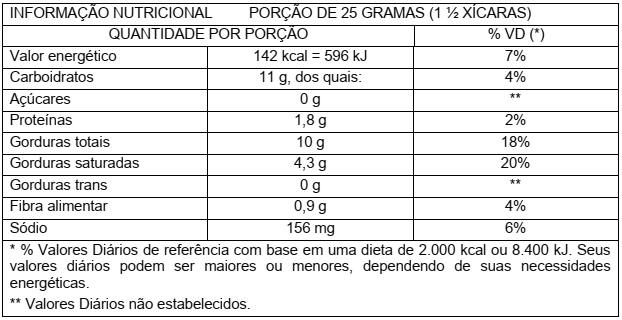
Considere que o total de gordura refere-se apenas a triglicerídeos. Com base nas informações acima, assinale a proposição CORRETA.
Segundo o rótulo do produto, seriam necessários mais de 30 pacotes de biscoito para suprir
a necessidade energética.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Em contato com a água, o sódio metálico reage gerando um forte aquecimento, fenômeno
típico de uma reação endotérmica.
