Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 350 questões
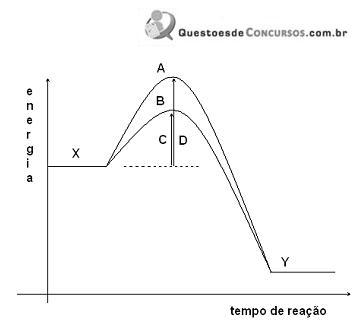
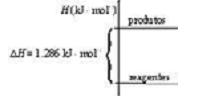
Com a análise do gráfico é CORRETO afirmar:
A manutenção da vida dos animais depende da energia que é obtida do consumo de alimentos como carboidratos, gorduras e proteínas. No entanto, carboidratos são as principais fontes de energia dos animais, estes sofrem combustão durante a respiração celular. Deve-se observar que cada mol de glicose em processo de combustão libera 720 kcal, conforme equação abaixo:
C6H12O6 + 6O2(g) → 6CO2(g) + 6H2O(l) + energia
Determine a variação de entalpia de formação (ΔHf) do monômero glicose (C6H12O6), a partir dos valores de ΔHf do CO2 e da H2O que são produtos da combustão deste açúcar.
C(s) + O2(g) → CO2(g) ΔHf = -95 kcal/mol
H2(g) + ½ O2(g) → H2O(l) ΔHf = -70 Kcal/mol
Imaginando-se que, para geração do hidrogênio, Charles usou cerca de 240,0 litros de solução aquosa de ácido clorídrico de concentração 12 mol.L-1 e 80,64 kg de ferro metálico puro, através da reação química representada pela equação:
Fe(s) + 2 HCl(aq) → FeCI2(aq) + H2(g)
Então, na temperatura de 25 ºC e pressão de 1 atm, o volume de gás hidrogênio, considerado gás ideal, para inflar o balão foi de aproximadamente:

Tendo o texto como referência inicial, julgue o item que se
segue, acerca de aspectos a ele relacionados
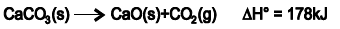
O calcário formado principalmente por carbonato de cálcio, CaCO3 (s), é um mineral importante na correção da acidez do solo, na produção de cimento e de óxido de cálcio CaO, conhecido como cal.
O Brasil utiliza cerca de um milhão de toneladas de óxido de cálcio por ano. A partir da decomposição térmica do carbonato de cálcio representada pela equação química, é correto afirmar:
Os combustíveis usuais são misturas de hidrocarbonetos que variam com a origem geográfica do petróleo utilizado e dos processos de refino aplicados. De fato, a mistura só pode ser comercializada se ela verifica características estritas sobre as propriedades físicas (densidade, volatilidade), energéticas (poder calórico) e químicas (índice de octanagem, limitação dos teores em certos componentes). Para determinar as propriedades energéticas dos combustíveis, um hidrocarboneto padrão serve como modelo. Para a gasolina, a referência é o octano C8H18.
Em um motor, é a reação de combustão da gasolina que fornece a energia necessária ao seu funcionamento. A energia liberada é proveniente do rearranjo das ligações químicas, conforme mostra a figura abaixo. O ciclo termodinâmico abaixo permite encontrar o valor de ΔrHo .
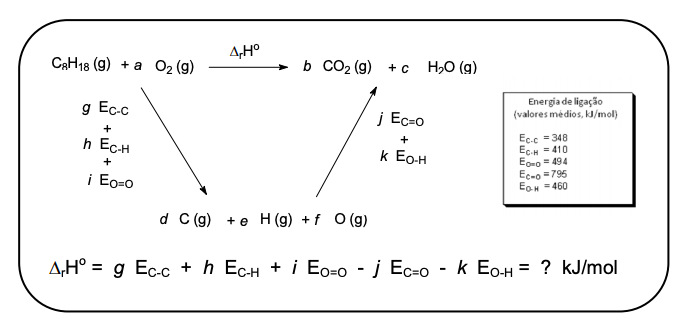
Considerando o ciclo termodinâmico acima e após o balanceamento das reações, indique com V as alternativas corretas e com F as alternativas falsas.
( ) A energia de combustão do octano é de –5.009,0 kJ/mol.
( ) A energia necessária para formar todas as ligações do gás carbônico produzido durante a reação de combustão do octano é de –6.360,0 kJ/mol.
( ) A energia necessária para formar todas as ligações da água produzida durante a reação de combustão do octano é de –4.140,0 kJ/mol.
( ) A energia necessária para quebrar todas as ligações do octano é de +10.164,0 kJ/mol.
( ) A energia necessária para a quebra de todas as ligações dos reagentes consumidos durante a reação de combustão do octano é +16.339,0 kJ/mol.
Assinale a alternativa que indique a sequência exata:
LIMA, A.C.S.; AFONSO, C., A Química dos Refrigerantes. Química Nova na Escola, 31(3), 2009. (adaptado)
As duas palavras que completam o texto são, respectivamente:
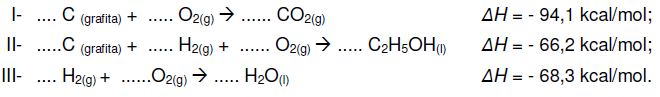
Sabendo-se que a variação de entalpia (∆H) de uma reação qualquer depende somente dos estados iniciais dos reagentes e do estado final dos produtos, marque a alternativa que corresponde aos coeficientes mínimos para a correta estequiometria das reações I, II e III, assim como a quantidade de calor produzida na combustão de 9,2 kg de álcool etílico líquido produzido [C2H5OH(l)], a partir dos coeficientes mínimos encontrados.
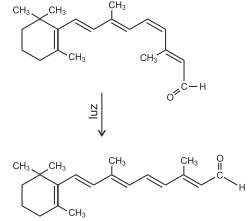
O processo de visão é iniciado na retina a partir de células fotorreceptoras que utilizam pigmentos contendo proteínas e o cis-retinal, um derivado da vitamina A, fotorreceptor. Durante o processo, o cis-retinal absorve luz e se transforma em trans-retinal, representados na equação química, gerando um impulso elétrico, que é enviado ao cérebro. O trans-retinal é reconvertido à forma cis, que absorve luz e dá continuidade ao processo.
A análise dessas informações permite concluir:
C6H4(OH)2(aq) + H2O2(aq)
 C6H4O2(aq) + 2 H2O(
C6H4O2(aq) + 2 H2O( ) hidroquinona
) hidroquinonaO calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
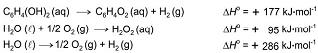
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é
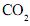 liberada na queima do combustível.
liberada na queima do combustível. Neste quadro, apresentam-se alguns hidrocarbonetos usados como combustíveis, em diferentes circunstâncias, bem como suas correspondentes variações de entalpia de combustão completa:
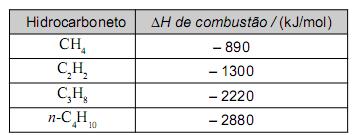
Tendo-se em vista essas informações, é CORRETO afrmar que, entre os hidrocarbonetos citados, aquele que, em sua combustão completa, libera a maior quantidade de energia por mol de
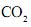 produzido é o
produzido é o 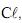 observou-se, durante a dissolução, um resfriamento do sistema
observou-se, durante a dissolução, um resfriamento do sistemaConsiderando-se a situação descrita e outros conhecimentos sobre o assunto, é CORRETO afrmar que
Julgue os itens abaixo relativos à situação hipotética acima, no que se refere ao equilíbrio térmico alcançado quando a água volta a entrar em ebulição.
I - As três peças estão em equilíbrio térmico com a água mas apresentam temperaturas diferentes umas das outras.
II - As três peças recebem a mesma quantidade de calor da água, tendo em vista que apresentam a mesma diferença de temperatura em relação à água em ebulição.
III - A peça de cobre é a que recebe mais calor, pois possui a maior condutividade térmica.
IV - A peça de poliestireno é a que recebe mais calor, porque apresenta a maior capacidade calorífica das três. No equilíbrio térmico, esta peça fica com a mesma temperatura (100°C) das demais e também da água que a envolve.
Está(ão) correto(s):
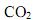 na atmosfera, resultante da queima de combustíveis orgânicos, contribui para a intensificação do efeito estufa e o conseqüente aumento no aquecimento global do planeta. A 25 °C, a queima do etanol e do metano libera 1.400 kJ/mol e 900 kJ/mol de energia, respectivamente. A razão entre a quantidade de energia liberada por mol de
na atmosfera, resultante da queima de combustíveis orgânicos, contribui para a intensificação do efeito estufa e o conseqüente aumento no aquecimento global do planeta. A 25 °C, a queima do etanol e do metano libera 1.400 kJ/mol e 900 kJ/mol de energia, respectivamente. A razão entre a quantidade de energia liberada por mol de 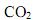 emitido pela combustão do etanol e do metano são, respectivamente:
emitido pela combustão do etanol e do metano são, respectivamente: As reações de formação do dióxido de enxofre e do trióxido de enxofre e as respectivas variações de entalpia, ΔH, são:
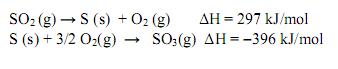
A formação de trióxido de enxofre a partir do dióxido de enxofre é dada pela reação:
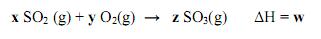
A alternativa que representa os valores indicados por x, y, z e w é:
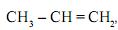 ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila, 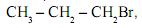 e o brometo de isopropila,
e o brometo de isopropila, 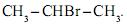
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:
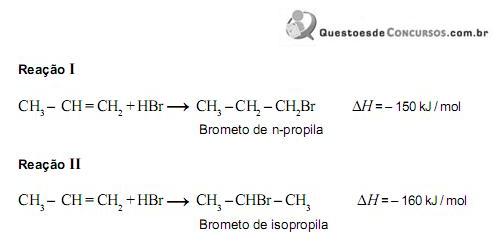
Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,


Com base nas informações do texto, julgue os itens de 19 a 33.
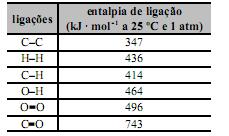
Considerando essas informações, conclui-se que o ΔH da reação de número X apresentada no texto, a 25 °C e 1 atm, o pode ser corretamente representado pelo gráfico abaixo.