Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 340 questões
I. Decomposição do mármore: CaCO3(s) →CaO(s) + CO2(g)
II. Produção do gás hidrogênio a partir do metano: CH4(g) + H2O(v) → CO(g) + 3H2(g)
III. Oxidação da sacarose: C12H22O11(s) + 12 O2(g) → 12 CO2(g) + 11 H2O(l)
Dados:
Tabela – Entalpia padrão de formação de algumas substâncias a 25 ºC e 1 atm.
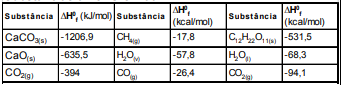
Calcule, a partir dos dados acima, a variação de entalpia das reações e assinale a opção correta:
Considere a equação termoquímica abaixo representada:
S(g) + 3/2 O2(g) -> SO3(s)
∆H= -94,4 kcal/mol
Podemos afirmar que, na formação de 200 g de trióxido de enxofre:
(I) H2O(l) → H2(g) + 1/2O2(g) ∆H = +286 kJ (II) H2(g) + ½ O2(g) → H2O(g) ∆H = - 242 kJ (III) H2O(l) → H2O(s) ∆H = - 7,3 kJ
De acordo com as equações acima e os seus conhecimentos de química, é incorreta a afirmativa:
O nitrato de potássio é um composto químico sólido, bastante solúvel em água, muito utilizado em explosivos, estando presente na composição da pólvora, por exemplo. Uma equação termoquímica balanceada para a queima da pólvora é representada abaixo:
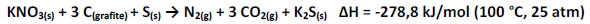
Assinale a alternativa que representa a interpretação correta da equação termoquímica para a queima da pólvora:
Considere a reação entre gás cloro e gás hidrogênio mostrada a seguir e ocorrendo em um sistema fechado:
Cl2(g) + H2(g) <-> 2HCI(g)
Dado: Constante dos gases (R) = 0,082 L.atm.mol-1.K-1.
Sobre esse processo, assinale a alternativa CORRETA:
Os efeitos globais gerados pela poluição advinda da queima de combustíveis fósseis tem levado à urgente necessidade por fontes alternativas de energia. Nesse contexto, o etanol (C2 H6O) e o gás hidrogênio (H2) emergem como possíveis substitutos da gasolina (C8 H18). A seguir estão apresentadas as reações de combustão de cada uma dessas espécies e os respectivos valores de entalpia padrão (25 ºC):
(Dadas as massas molares em g/mol: H=1, C=12, O=16)
C8
H18 + 12,5 O2 -> 8 CO2
+ 9 H2O
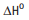 = –5471 kJ/mol
= –5471 kJ/mol C2
H6O + 3 O2 -> 2 CO2
+ 3 H2O
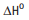 = –1368 kJ/mol
= –1368 kJ/mol H2
+ ½ O2 -> H2O
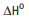 = –286 kJ/mol Com base nessas informações, pode-se afirmar que:
= –286 kJ/mol Com base nessas informações, pode-se afirmar que: H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25oC:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1 Equação 2 II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1 Equação 3 III - CO2 (g) + H2O(l) → H2CO3(aq) ΔH° = - 20,5 kJmol-1 Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
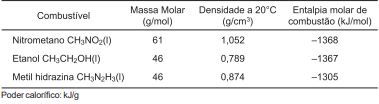
A tabela apresenta os valores de densidades, massa molar e entalpia molar de combustão de alguns combustíveis.
Considerando-se essas informações e com base nos conhecimentos de termoquímica, é correto afirmar:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
Substância ΔH combustão (kcal/mol) C2H4(g) -337,3 H2(g) -68,3 C2H6(g) -372,8
O valor da variação de entalpia na hidrogenação catalítica do eteno, descrita pela reação abaixo, é:
C2H4(g) + H2(g) → C2H6(g)
I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:


Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para

O diagrama representa a entalpia de formação do pentacloreto de fósforo a partir de duas variedades alotrópicas de fósforo, o fósforo branco e o fósforo vermelho.
A partir da análise desse diagrama, é correto afirmar:
H(g) + Cl(g) - 431.Kj → HCl(g) Hidrogênio
 Cloro
Cloro  Cloreto de Hidrogênio
Cloreto de Hidrogênio 

Em relação às combinações do hidrogênio com o cloro, é CORRETO afirmar que:
Dados:
Massa atômica: C = 12 O = 16 Cgrafite + O2(g) → CO2(g) ΔH= - 393,5 kJ/mol Cdiamante + O2(g) → CO2(g) ΔH= - 395,4 kJ/mol

I. (CH2O)n + O2 → CO2 + H2O + Energia II. H2O + CO2 + hν → (CH2O)n + O2
Sobre os processos, é CORRETO afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:
