Questões de Vestibular
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 346 questões
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:

A Termoquímica é a área da química que estuda as reações químicas e os fenômenos físicos em que ocorrem absorção ou liberação de energia na forma de calor.
Assim, é incorreto afirmar que a entalpia de uma reação é afetada pelo(a):Instrução: Leia atentamente o texto abaixo para responder a questão.


A entalpia de combustão do carbono, a 25 °C, é de 393,5 kJ.mol−1. Considerando 1,0 kg de turfa, um tipo de carvão mineral que contém somente 60% de carbono, em média, a energia liberada, em kJ, somente pela queima de carbono é de, aproximadamente,
Dado:
massa molar do C = 12 g.mol−1

8Li(s) + SF6(g) → Li2S(s) + 6LiF(s)
Com base nos conhecimentos da Química, considerando-se a tecnologia de adaptação de energia química armazenada para ogivas de torpedos, desenvolvida pela Marinha dos EUA, relacionando-a às informações do texto e à equação química, é correto concluir:
A massa de hidrogênio, em gramas, necessária para gerar a mesma quantidade de energia que a gerada por 1 g de dodecano equivale a:
Utilize as informações a seguir para responder à questão.
Cada mol de glicose metabolizado no organismo humano gera o equivalente a 3 000 kJ de
energia. A atividade da célula nervosa, em condições normais, depende do fornecimento
constante dessa fonte energética.
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
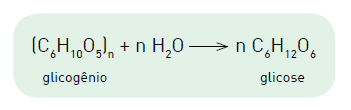
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 . A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
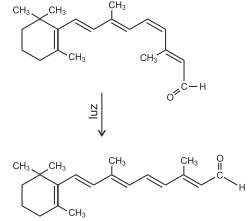
O processo de visão é iniciado na retina a partir de células fotorreceptoras que utilizam pigmentos contendo proteínas e o cis-retinal, um derivado da vitamina A, fotorreceptor. Durante o processo, o cis-retinal absorve luz e se transforma em trans-retinal, representados na equação química, gerando um impulso elétrico, que é enviado ao cérebro. O trans-retinal é reconvertido à forma cis, que absorve luz e dá continuidade ao processo.
A análise dessas informações permite concluir:
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
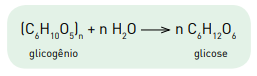
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona
o ganho de energia, em quilojoules, equivalente a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas. (www.osorio.rs.gov.br. Adaptado.)
Considere agora a combustão completa do metano, principal componente do gás natural, cuja entalpia de combustão completa é cerca de – 9 × 102 kJ/mol, e que as transformações de energia nessa combustão tenham eficiência ideal, de 100%.
Para fornecer a mesma quantidade de energia obtida pelo Parque Eólico de Osório quando opera por 1 hora com sua capacidade máxima, uma usina termoelétrica a gás necessitaria da combustão completa de uma massa mínima de metano da ordem de
Considere que a massa molar do principal componente do biogás é 16 g/mol e que sua combustão completa produz 802 kJ/mol, nas condições experimentais. A quantidade de energia gerada ao final de um dia, em que houve a formação de 1 kg desse componente do biogás é
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
É dada a equação não balanceada: ZnS(s) + O2(g) → ZnO(s) + SO2(g) e conhecem-se os valores do calor de combustão do zinco = -108,85 kcal/mol, e dos calores de formação do ZnS = - 44,04 kcal/mol, e do SO2 = - 71,00 kcal/mol. Com essas informações, pode-se afirmar corretamente que o calor de formação do óxido de zinco será, em kcal/mol, aproximadamente
DADOS QUE PODEM SER USADOS NESTA PROVA:

ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1. Colocou-se 30 mL de água destilada em um béquer de capacidade de 100 mL.
2. Adicionou-se, neste mesmo béquer, 30 mL de álcool isopropílico.
3. Com um bastão de vidro, fez-se agitação na solução.
4. Em seguida, mergulhou-se uma cédula de R$ 100,00 no béquer contendo a solução, e deixou-se que a cédula embebesse a solução por dois minutos.
5. Com uma pinça de madeira, retirou-se a cédula do béquer pinçando-a por uma das pontas.
6. A cédula foi então submetida à chama de uma vela, para que ela queimasse; essa ação permitiu a combustão do álcool isopropílico.
7. Observou-se em seguida que, apesar de a cédula ter sido submetida ao fogo da chama da vela, ela não queimou, ficando da mesma forma que estava antes da experiência.
Com relação a essa experiência, assinale a afirmação verdadeira.
