Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões
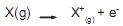
Esse é um processo endotérmico, porque o elétron é atraído pelo núcleo positivo, portanto, deve-se fornecer energia para removê-lo. Uma vez que todos os átomos, exceto o hidrogênio, possuem mais do que um elétron, eles também possuem mais de um potencial de ionização. Considerando essa informação, escolha a alternativa que apresenta o átomo com maior potencial de ionização dentre os pares abaixo:
(1) B ou C; (2) O ou Si; (3) Cl ou As.
Analise os processos a seguir:
I. oxidação de nitrogênio: N2(g) + 2O2(g) →2NO2(g)
II. fotossíntese da glicose: 6CO2(g) + 6H2O(g) → C6H12O6(s) + 6O2(g)
III. evaporação da água de roupas úmidas
IV. dissolução do sal: KNO3(s) → K+ (aq) + NO3 - (aq)
Ocorre aumento de entropia durante os processos
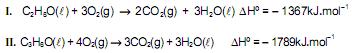
Os processos de combustão do etanol,
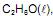 utilizado como combustível em veículos, e da propanona,
utilizado como combustível em veículos, e da propanona, 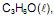 solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II.
solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II. Considerando-se essas informações e a densidade do etanol igual a 0,8g.mL, é correto concluir:
saponificação dos óleos vegetais são utilizados como sabões.
Entretanto, em regiões cujas águas são ricas em metais
alcalinoterrosos (chamadas águas duras), principalmente Ca2+ eMg 2+
, os sabões perdem eficiência devido à baixa solubilidade dos
sais orgânicos desses metais, o que causa a precipitação.
Com base nessas informações e considerando as soluções ideais,
julgue os itens 148 e 149 e assinale a opção correta no item 150, que
é do tipo C.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.