Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 724 questões
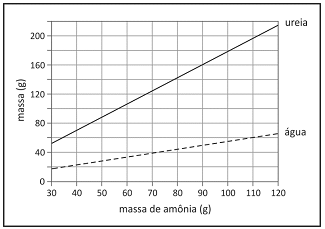
Amônia e gás carbônico podem reagir formando ureia e água. O gráfico ao lado mostra as massas de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
A partir dos dados do gráfico e dispondo-se de 270 g de amônia, a massa aproximada, em gramas, de gás carbônico minimamente necessária para reação completa com essa quantidade de amônia é
Na notícia “Nova Iorque planeja liderança em reciclagem”, do site da Science American Brasil, há importantes referências ao sofisticado sistema de separação dos materiais presentes no lixo dessa cidade.
“A primeira coisa que a usina do Brooklyn fará é rasgar e remover as sacolas plásticas que tantos nova-iorquinos usam para empacotar seus recicláveis. O vidro será moído, separado e transportado pelo Porto de Nova York até Nova Jersey, onde ele passará por uma nova máquina de raios-x para ser novamente separado; contaminantes como boro e vidro com chumbo também serão removidos. De volta ao Brooklyn, outros recicláveis passam por uma correia transportadora enquanto ímãs extraem metais ferrosos.
O plástico e o alumínio restantes são passados por correntes de Foucault, que extraem o alumínio.”
TWEED, Katherine. Nova Iorque planeja liderança em reciclagem. Scientifi c American Brasil.
(http://www2.uol.com.br/sciam/noticias/nova_iorque_ planeja_lideranca_em_reciclagem.html).
Sobre os materiais citados no texto, é correto afirmar
que
Em relação aos nitritos e nitratos, é correto afirmar que
Água coletada em Fukushima em 2013 revela radioatividade recorde
A empresa responsável pela operação da usina nuclear de Fukushima, Tokyo Electric Power (Tepco), informou que as amostras de água coletadas na central em julho de 2013 continham um nível recorde de radioatividade, cinco vezes maior que o detectado originalmente. A Tepco explicou que uma nova medição revelou que o líquido, coletado de um poço de observação entre os reatores 1 e 2 da fábrica, continha nível recorde do isótopo radioativo estrôncio-90.
(www.folha.uol.com.br. Adaptado.)
O estrôncio, por apresentar comportamento químico semelhante ao do cálcio, pode substituir este nos dentes e nos ossos dos seres humanos. No caso do isótopo Sr-90, radioativo, essa substituição pode ser prejudicial à saúde. Considere os números atômicos do Sr = 38 e do Ca = 20. É correto afirmar que a semelhança de comportamento químico entre o cálcio e o estrôncio ocorre porque
CO(g) + H2(g) → H3 COH(g)
Nesta equação
2 ZnS + 3 O2 → 2 ZnO + SO2
ZnO + CO → Zn + CO2
Supondo que as duas etapas tenham rendimento total e que os demais reagentes estejam em quantidade suficiente, a partir de 8,5 mols de sulfeto de zinco a massa aproximada de zinco obtida, em gramas, será
Dados:
Zn - 65 u
S - 32 u
O - 16 u
N2 H4(g) + 2 H2 O2(l) → N2(g) + 4 H2O(g) ΔH = - 644,0 kJ
Com excesso de peróxido de hidrogênio e supondo 100% o rendimento da reação, é possível determinar a massa de hidrazina que, ao ser consumida, produzirá energia equivalente a 2.576 kJ. Esse valor, em gramas, é
Dados:
N - 14 u
H - 1 u
O - 16 u
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Uma das substâncias aglutinadoras que pode ser utilizada para a nucleação artificial de nuvens é o sal iodeto de prata, de fórmula AgI. Utilizando os dados fornecidos na Classificação Periódica dos Elementos, é correto afirmar que o cátion e o ânion do iodeto de prata possuem, respectivamente,
Dados de massas molares em g mol-1 : C=12; N=14 e O=16.
CH3OH(g)+ 3/2 O2(g) → CO2(g) + 2 H2O(g) combustão direta
CH3OH(g)+H2O(g) → CO2(g) + 3H2(g) H2(g)+ ½ O2(g) → H2O(g) geração e queima de hidrogênio
De acordo com essas equações, o processo de geração e queima de hidrogênio apresentaria uma variação de energia
Dados: Equação da reação: ½ N2 + O2 → NO2
Massas molares em g mol-1: N2=28 , O2=32 e NO2= 46
Cl + e- → Cl-
Na - e- → Na+
Como resultado dessas transferências de elétrons, os raios iônicos das espécies Cl - e Na+ , quando comparado com seus respectivos raios atômicos, irão, respectivamente

Desde a década de 70, não há comercialização do minério bruto ou do concentrado de nióbio (pirocloro) no mercado interno ou externo. O metal é vendido, sobretudo, na forma da liga ferro-nióbio (FeNb STD, com 66% de teor de nióbio e 30% de ferro), obtida a partir de diversas etapas de processamento. Segundo o governo, as exportações de ferro-liga de nióbio atingiram em 2012 aproximadamente 71 mil toneladas, no valor de US$ 1,8 bilhão.
(http://g1.globo.com. Adaptado.)
A água de coco é considerada uma bebida muito saudável e indicada para reposição de íons após atividades físicas intensas. Em especial, é uma rica fonte de potássio, que contribui para evitar cãibras. Além disso, a água de coco contém açúcares, que fornecem energia para o organismo. Essa bebida não contém quantidades significativas de proteínas e gorduras. Em uma amostra de água de coco de 200 g (aproximadamente um copo), foram encontradas as seguintes quantidades:
Açúcares 8,0 g
Cálcio 40 mg
Sódio 40 mg
Potássio 156 mg
Magnésio 12 mg
Com base nessas informações, é correto afirmar que a água de coco
A Classificação Periódica dos Elementos é importante ferramenta dos químicos. Sobre esse assunto, são feitas as seguintes afirmativas:
I. Os elementos prata e chumbo apresentam, respectivamente, massa atômica aproximada de 108 e 207.
II. Com exceção do hidrogênio, os elementos da extremidade esquerda da tabela periódica são metais de transição.
III. Na tabela periódica atual, os elementos são organizados em função do seu número atômico.
IV. Em geral, elementos representativos de mesmo grupo da tabela periódica apresentam massas atômicas similares.
São corretas somente as afirmativas