Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 720 questões
A primeira lâmpada comercial, desenvolvida por Thomas Edison, consistia em uma haste de carbono, que era aquecida pela passagem de uma corrente elétrica a ponto de emitir luz visível. Era, portanto, uma lâmpada incandescente, que transforma energia elétrica em energia luminosa e energia térmica. Posteriormente, passou-se a utilizar, no lugar da haste, filamentos de tungstênio, cuja durabilidade é maior. Hoje, esse tipo de lâmpada tem sido substituído pelas lâmpadas fluorescentes e de LED.
As lâmpadas fluorescentes são construídas com tubos de vidro transparente revestidos internamente e contêm dois eletrodos (um em cada ponta) e uma mistura de gases em seu interior — vapor de mercúrio e argônio, por exemplo. Quando a lâmpada fluorescente é ligada, os eletrodos geram corrente elétrica, que, ao passar através da mistura gasosa, excita seus componentes, os quais, então, emitem radiação ultravioleta. O material que reveste o tubo tem a propriedade de converter a radiação ultravioleta em luz visível, que é emitida para o ambiente.
A lâmpada de LED é mais econômica que a incandescente, pois dissipa menos energia em forma de calor. Em geral, essas lâmpadas têm eficiência de 15 lumens por watt. Um lúmen (unidade padrão do Sistema Internacional) é o fluxo luminoso emitido por uma fonte puntiforme com intensidade uniforme de 1 candela e contido em um cone de ângulo sólido de um esferorradiano. A tabela a seguir apresenta características específicas das lâmpadas incandescentes, fluorescentes e de LED.

A partir do texto acima e considerando que 6,63 × 10-34 J-s seja o valor da constante de Planck, que 3 × 108 m/s seja a velocidade da luz e que a temperatura em graus Kelvin seja exatamente igual à temperatura em graus Celsius acrescida de 273, julgue o item.
O tungstênio tem maior raio atômico e menor energia de
ionização que o carbono.

O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
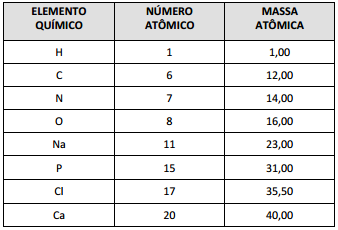
DADOS QUE PODEM SER USADOS NESTA PROVA
O fermento é responsável pelo aumento do volume de um bolo, que acontece assim: a temperatura alta faz com que o fermento libere gás carbônico; esse gás se expande e faz o bolo crescer. Quando adicionado na massa, o fermento sofre uma transformação química a partir da reação entre bicarbonato de sódio e fosfato dihidrogenado de cálcio:
NaHCO3 + Ca(H2 PO4)2 —–>
Assinale a opção que apresenta corretamente os
produtos ajustados dessa reação química.
TEXTO 3
O acendedor de lampiões
Lá vem o acendedor de lampiões da rua!
Este mesmo que vem infatigavelmente,
Parodiar o sol e associar-se à lua
Quando a sombra da noite enegrece o poente!
Um, dois, três lampiões, acende e continua
Outros mais a acender imperturbavelmente,
À medida que a noite aos poucos se acentua
E a palidez da lua apenas se pressente.
Triste ironia atroz que o senso humano irrita: —
Ele que doura a noite e ilumina a cidade,
Talvez não tenha luz na choupana em que habita.
Tanta gente também nos outros insinua
Crenças, religiões, amor, felicidade,
Como este acendedor de lampiões da rua!
(LIMA, Jorge de. Melhores poemas. 3. ed. São Paulo: Global, 2006. p. 25)
O Texto 3 faz referência à iluminação, elemento fundamental na vida das pessoas. Dos lampiões a querosene ao LED, tem-se uma ideia de como a evolução da iluminação contribuiu para a transformação das cidades e dos hábitos das pessoas. Essa evolução vai da utilização do óleo ao querosene, deste ao gás, chegando finalmente à energia elétrica. Foi apenas no século XX que a eletricidade passou a ser popularmente usada na iluminação das ruas. Vários tipos de lâmpadas foram utilizadas em iluminação pública: incandescente, halógena, fluorescente linear, lâmpada mista, lâmpada a vapor de mercúrio, lâmpada a vapor de sódio de alta pressão. A tecnologia é desenvolvida, aplicada e melhorada. Atualmente, além da eficiência e economia, o light emitter diode ou LED é a tecnologia que permite melhor relação com o meio ambiente, porque não utiliza mercúrio, que é tóxico.
(Adaptado de CODI - Comitê de Distribuição - Substituição de lâmpadas incandescentes no sistema de iluminação pública - Relatório SCPE.33.01 de 13 out. 1988. Comitê de Distribuição (CODI), Abradee, Rio de Janeiro, 1988.)
O LED é um componente eletrônico semicondutor que transforma energia elétrica em luz. Essa transformação é diferente daquela encontrada nas lâmpadas convencionais, que utilizam filamentos metálicos, radiação ultravioleta e descarga de gases. No arsenieto de gálio
ou no fosfeto de gálio, por exemplo, ocorre a eletroluminescência,
que é a emissão de luz com aplicação de uma
fonte elétrica.
I-No estado fundamental, o átomo de arsênio apresenta um orbital completo na camada de valência.
II-Fósforo e arsênio apresentam cinco camadas de energia em sua distribuição eletrônica, no estado fundamental, pois estão localizados no mesmo período da tabela periódica.
III-Apenas os elétrons da camada de valência do gá- lio em seu estado fundamental apresentam valores idênticos para todos os números quânticos – principal, secundário, magnético e spin.
IV-No LED, a maior parte da energia absorvida é dissipada na forma de calor.
É(são) correto(s) apenas o(s) item(ns):
A pólvora é considerada a primeira mistura explosiva, usada na China, na Arábia e na Índia. Há textos chineses antigos que a denominam “substância química do fogo”, mesmo sendo uma mistura de nitrato de potássio, carvão e enxofre. A combustão da pólvora pode ser representada pela seguinte equação:
4KNO3 + 7C + S → 3CO2 + 3 CO + 2 N2 + K2CO3 + K2S
O que caracteriza a explosão é o súbito aumento de
volume, com grande liberação de energia. Nas CNTP,
520 g de pólvora produzem, por explosão,
INSTRUÇÃO: Para responder à questão, analise
as informações a seguir.
O fogo sempre foi objeto de fascínio e instrumento de extrema utilidade para o ser humano. Mesmo hoje, com o uso cada vez mais disseminado da energia elétrica, não deixamos de utilizar o fogo no cotidiano: ainda queimamos carvão na churrasqueira, lenha na lareira, gás liquefeito de petróleo no fogão e parafina nas velas.
Sobre esse assunto, são apresentadas as seguintes afirmativas:
I. A combustão é uma reação redox em que o comburente age como oxidante.
II. Na combustão do gás de cozinha, há produção de água, mas na do carbono não há.
III. A velocidade de combustão do carvão em pedaços é igual à do carvão em pó.
IV. As reações de combustão são exotérmicas e liberam gás carbônico.
Em relação à combustão, são corretas somente as
afirmativas
Os compostos (NH4)H2PO4 e NaHCO3 são usados em extintores como agentes de combate ao fogo. Quando lançados sobre uma chama, ocorrem as seguintes transformações:
(NH4)H2PO4 → NH3 + H3PO4
H3PO4 → polifosfato (viscoso)
NaHCO3 → CO2 + H2O + Na2CO3 (particulado).
No combate a todos os tipos de incêndio, a nuvem formada
de gás é importante, mas naqueles envolvendo materiais
sólidos, o depósito do material oriundo da transformação
do agente de combate sobre o combustível tem papel
decisivo. Assim, o agente (NH4)H2PO4 pode substituir o
NaHCO3 em qualquer situação, mas o contrário não é
verdade. Isso permite concluir que no combate ao incêndio
que envolve
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de eletricidade.
III Para ser usado como “secante de armário", o sal deve ser higroscópico.
São verdadeiras:
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
I. 6 NH3 (g) + 15/2 O2 (g) → 6 NO (g) + 9 H2O (g) ∆H = – 1378 kJ
II. 6 NO (g) + 3 O2 (g) → 6 NO2 (g) ∆H = – 339 kJ
III. 6 NO2
(g) + 2 H2O (g) → 4 HNO3
(aq) + 2 NO (g) ∆H = – 270 kJ
