Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 724 questões
• Sobre volume de meio copo (~100 mL) do extrato líquido, adicionaram-se 20 mL de solução salina de cloreto de sódio (1 mol L -1 ). A cor roxa do extrato foi mantida. • Sobre volume de meio copo do extrato líquido, adicionou-se suco de um limão. A cor do extrato líquido se tornou vermelha.
Foi observado aspecto opaco (turvo) no extrato líquido logo em seguida à sua separação das folhas de repolho, e esse aspecto se manteve durante todos os experimentos.
Sobre esse experimento, considere as seguintes afirmativas:
1. A mudança de cor de roxa para vermelha no segundo experimento é evidência de que ocorreu uma transformação química no extrato. 2. O extrato líquido é uma mistura homogênea. 3. Nos 20 mL de solução salina existem 1,2 x 1022 íons Na+ e 1,2 x 1022 íons Cl– .
Assinale a alternativa correta.
Uma amostra de 30,695g de calcário (carbonato de cálcio) é aquecida a alta temperatura e se decompõe conforme a reação de calcinação
CaCO3(s) —> CaO(s) + CO2(g).
Após um aquecimento vigoroso, o calcário sofreu decomposição completa e depois de resfriado foi pesado e acusou 30,14g. Com base nestas informações, determine o volume de gás liberado na CNTP.
(DADO: C = 12, O = 16 , Ca =40)
Numa sessão de estudos, alunos do Ensino Médio necessitavam responder a questão que tinha a seguinte informação: S(g) + 3/2 O2(g) → SO3(g) ΔH = -94,4Kcal/mol que é a equação termoquímica de um problema.
Pode-se afirmar que quando 120g de SO3(g) são formados: (Dado: S = 32g, O = 16g)
Com relação às equações abaixo:
CaO(s) + CO2(g) → CaCO3(s)
2NaI(aq)+ Br(aq) → 2 NaBr(aq) + I2(aq)
com certeza são exemplos de reações de:
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
Relacione corretamente as equações com as reações químicas do cotidiano apresentadas abaixo, numerando a Coluna II de acordo com a Coluna I.
Coluna I
(1) 2NaHCO3 →Na2CO3 + CO2 + H2O
(2) Mg(OH)2 + CO2→MgCO3 + H2O
(3) 2NH3 + CO2 →CO(NH2)2 + H2O
(4) NaHCO3 + HCℓ→NaCℓ + H2CO3
Coluna II
( ) Produção de substância usada como fertilizante.
( ) Ação do sal de fruta no estômago humano.
( ) Feitura do bolo de chocolate.
( ) Absorção
do gás de
ambientes
fechados.
A sequência correta, de cima para baixo, é:
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
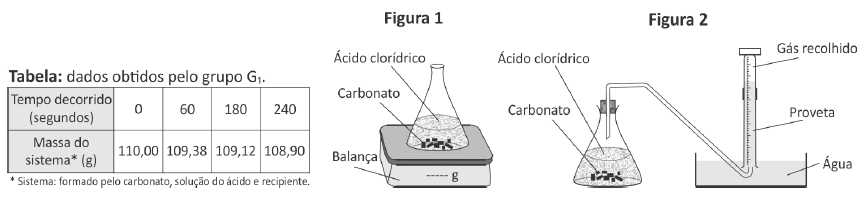
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
Na estratosfera, há um ciclo constante de criação e destruição do ozônio. A equação que representa a destruição do ozônio pela ação da luz ultravioleta solar (UV) é
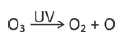
O gráfico representa a energia potencial de ligação entre um dos átomos de oxigênio que constitui a molécula de O3 e os outros dois, como função da distância de separação r.
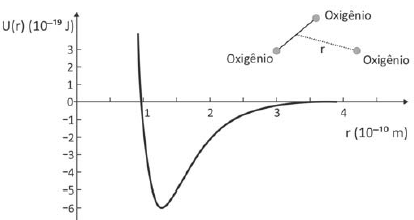
A frequência dos fótons da luz ultravioleta que corresponde à energia de quebra de uma ligação da molécula de ozônio para formar uma molécula de O2 e um átomo de oxigênio é, aproximadamente,
Note e adote:
E = hf
E é a energia do fóton.
f é a frequência da luz.
Constante de Planck, h = 6 x 10-34 J.s
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de pureza, a massa de mercúrio produzida pela ustulação de uma tonelada do composto é
Dado: Volume de 1 mol de gás na CNTPé 22,4 L
A água oxigenada é o nome dado à solução comercial de peróxido de hidrogênio (H2 O2 ) em água. Em lojas de produtos químicos é possível adquirir frascos contendo água oxigenada 200 volumes. Essa concentração indica que a decomposição total do peróxido de hidrogênio contida em 1,0 L de solução produz 200 L de gás oxigênio medidos na CNTP.
A reação de decomposição da água oxigenada é representada pela equação química a seguir

Desse modo, 50 mL dessa solução contém,
aproximadamente,
Dado: 1 pm equivale a 10-12 m
O raio iônico é a grandeza que mede o tamanho dos íons. Conhecer o raio dos íons auxilia na análise da energia reticular dos cristais iônicos, na compreensão da seletividade dos canais iônicos das membranas celulares e na interação dos íons em sítios específicos de enzimas.
Considerando os íons Ca2+, Cl– , K+, e Mg2+, a alternativa que melhor associa esses íons aos valores de raios iônicos é
I. A pólvora negra é uma mistura de carvão vegetal, nitrato de potássio e enxofre em que predominam substâncias representadas, respectivamente, por: C, KNO3 e S.
II. A neutralização do hidróxido de amônio é representada por: NH4 Cl(s) + H2 O(l) → NH4 + (aq) + OH- (aq) + H+ (aq) + Cl- (aq).
III. A combustão de uma porção de palha de aço é representada pela seguinte equação: 2 Fe(s) + O2(g) → 2 FeO(s)
IV. Os elementos químicos do terceiro período da tabela periódica − que estão, respectivamente, no segundo e terceiro grupos − são representados por: Mg e Al.
De acordo com as informações acima, são corretas apenas as afirmativas

