Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 724 questões

I - Em ambas as combustões (queima do papel e queima da esponja de aço) são produzidos gás carbônico e Água. II - A combustão da esponja de aço tem como produtos óxidos de Ferro. III - A combustão do papel tem como produtos água e outros materiais.
Está(ão) correta(s) a(s) afirmativa(s):

DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
Os extintores de incêndio à base de espuma contêm soluções aquosas de sulfato de alumínio e bicarbonato de sódio. Sobre a chama ocorre a reação cuja equação não balanceada é:
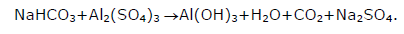
Com relação a reação anterior e seus efeitos
sobre a chama, assinale a afirmação FALSA.
Considerando-se essas informações, é correto afirmar:
A partir da concepção de Robert Boyle e do conceito moderno de elemento químico, é correto afirmar:
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Ao ingerirmos fígado de boi, couve ou gemas de ovos, temos uma dieta rica em ferro.
Sobre o ferro, é CORRETO afirmar que
Muitos dos estudos mais antigos sobre as reações do ouro surgiram da prática da alquimia com objetivo de transformar metais nesse elemento químico. Os alquimistas descobriram que o ouro pode ser dissolvido em uma mistura de ácidos clorídrico e nítrico concentrados, na proporção de 3:1, conhecida como água régia, de acordo com a equação química simplificada não balanceada.
Considerando-se essas informações e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Massas molares em g/mol: Xe = 131; Pt = 195; F = 19
CITONHO Doutor Noêmio, desculpe a indiscrição. Andaram me falando de uma coisa, mas eu não quis de maneira nenhuma acreditar. Me disseram que o senhor é de uma raça que só come folha. DR. NOÊMIO Pois pode acreditar. Sou vegetariano e tenho muito orgulho disto. CITONHO Mas a gente vê umas neste mundo! Não está vendo que tomate e chuchu não dão sustança a ninguém?! Agora: feijão, farinha e carne, sim, isso é que é comida. Olhe aqui eu. Estou com mais de oitenta anos, só não como carne na Sexta-feira da Paixão – e olhe lá... Resultado: uma saúde de ferro: estou tinindo. DR. NOÊMIO Isso é o que o senhor pensa. Seu corpo está envenenado, meu velho, com toxinas até na ponta dos cabelos. Até na sombra.
[...]
FREDERICO Eu só rezo pra defunto. Interessa? Liás, cabra safado não serve pra morrer, só serve pra apanhar. E apanhar entre os bicos dos peitos e o caroço do imbigo, que é pra não deixar marcas da surra. Ah!, nós três num deserto: eu, você e um cacete de quixaba! Porque quixaba é o chá melhor que existe no mundo pra pancada. Assim, pra ganhar tempo, a gente dá logo a pisa com quixaba, porque está dando o castigo e o remédio. Mas já gastei muita cera com você. [...]
(LINS, Osman. Lisbela e o prisioneiro. São Paulo: Planeta, 2003. p. 22 e 25.)
O tomate, mencionado no texto 01, quando fresco, tem baixo poder calórico, baixo teor de matéria seca, uma vez que apresenta em sua composição alto teor de água, é muito rico em cálcio e boa fonte de ácido fólico. As espécies minerais do tomate são constituídas de potássio, nitrogênio e fósforo. Além destes, o tomate contém outros componentes, como vitamina K e flavonoides. Ele ainda apresenta alto teor de caroteno, tiamina, niacina e vitamina C. É um alimento rico em licopeno, pigmento responsável pela sua coloração vermelha. O sabor é dado, principalmente, pelos teores de vários açúcares, que constituem os sólidos solúveis totais (frutose, glicose e sacarose) e ácidos orgânicos (cítrico, málico). Entre estes, o mais abundante é o ácido cítrico.
(Disponível em: <http://www.vigorevida.com.br/materiais/tomate.htm>. Acesso em: 04 nov. 2010)
Ainda de acordo com o texto acima , sobre, o tomate, marque a única alternativa correta:
Considerando as informações do texto, têm-se as seguintes afirmativas: I - O suor é uma mistura heterogênea do tipo suspensão. II - A densidade do suor é a razão entre seu volume e sua massa e representa uma propriedade química. III - O suor sobre a pele desaparece quando o atleta pára de jogar, porque retira energia térmica do corpo para transformar seu estado físico de líquido para gasoso. IV - Os íons sódio e potássio, contidos no suor, são metais alcalinos e pertencem ao primeiro grupo da tabela periódica. V - Os íons sódio, potássio e magnésio, liberados durante a transpiração, possuem cargas iguais a +1, +1 e +2, respectivamente.
Assinale a alternativa que reúne somente afirmativas corretas.
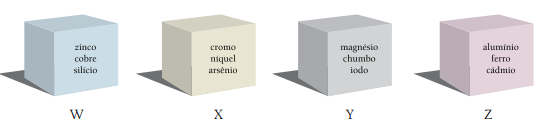
A única caixa que contém apenas metais está indicada pela seguinte letra:
Uma forma de evitar a poluição ambiental causada pelo descarte de óleo de cozinha usado é reaproveitá-lo para produzir sabões, que são sais de ácidos carboxílicos. Para tanto, faz-se reagir o óleo com solução aquosa fortemente alcalina de NaOH e/ou KOH.
Nessa reação, conhecida como reação de saponificação, forma-se também um outro produto que é o
Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos apresentam igual
I. número de prótons;
II. número de elétrons na camada de valência;
III. eletronegatividade.
É correto o que se afirma em
