Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 730 questões
Responda à questão com base na tabela abaixo sobre o rótulo da garrafa de uma determinada marca de refrigerante.

* Valores Diários com base numa dieta de 2 000 kcal ou 8 400 kJ
Observe a foto, que mostra a grande diversidade fenotípica do ser humano.

Fonte: http://www.brasilescola.com/upload/e/diversidade%20cultural(1).jpg
Apesar das enormes diferenças entre os seres humanos, podemos afirmar que basicamente os elementos
químicos em maior porcentagem são sempre os mesmos. Quais são esses elementos químicos?
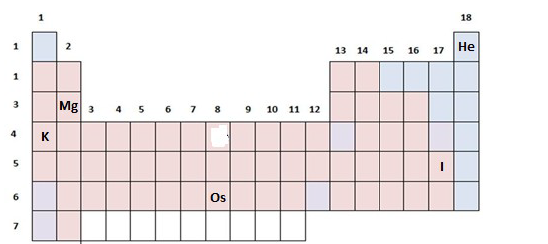
Os cinco símbolos de elementos presentes na tabela periódica acima, com todos os outros omitidos, são, respectivamente, da esquerda para a direita,
Fe(s) + 2 HCl(aq) → FeCl2(aq) + H2(g)
Então, na temperatura de 25 ºC e pressão de 1 atm, o volume de gás hidrogênio, considerado gás ideal, para inflar o balão foi de aproximadamente:
Dados:
Massas Molares (g.mol-1): H = 1,0; Cl = 35,5 e Fe = 56,0; R = 0,082 L.atm.K-1.mol-1 (Constante Universal dos Gases); T (K) = T(ºC) + 273.
A partir do conhecimento dessas relações, é correto afirmar
De acordo com essas considerações e destacando-se o átomo de zircônio, 40Zr — um metal utilizado no revestimento de metais e de fornos —, é correto afirmar
X + NaOH → R-CO2Na + R´-OH ,
qual é a espécie X e a classificação da reação?
O elemento químico X, comum às três ligas, latão (Zn + X), bronze (Sn + X) e ouro vermelho (Au + X), é isoeletrônico com Zn2+ quando seu próprio número de oxidação é igual a +1, e conserva sua alta condutibilidade elétrica e térmica ao compor as ligas. O elemento químico com as características citadas é
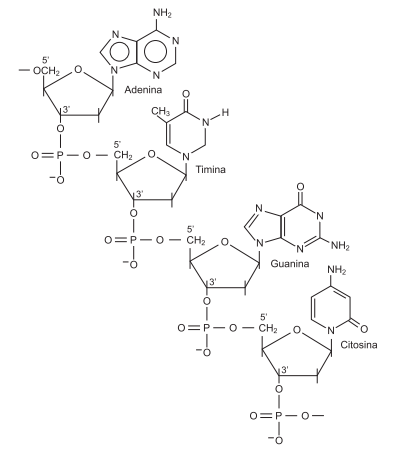
Existe vida de uma forma completamente diferente de tudo que se conhece até agora. A descoberta revelada pela Nasa é de uma bactéria que pertence ao grupo das halomonodáceas, que vive nas águas salgadas e ricas em arsênio do lago Mono, na Califórnia. A bactéria é uma forma de vida que incorpora no DNA, no lugar do fósforo, um elemento químico tóxico que não deveria fazer parte, em tese, da química da vida: o arsênio.
Uma análise dessas informações e da sequência de nucleotídeos do DNA, representada pela estrutura na figura, permite afirmar:
Com base nessas considerações e comparando-se as propriedades dos elementos químicos rubídio e iodo, é correto afirmar:
O raio atômico é uma propriedade periódica cuja variação em função do número atômico é mostrada no gráfico abaixo.
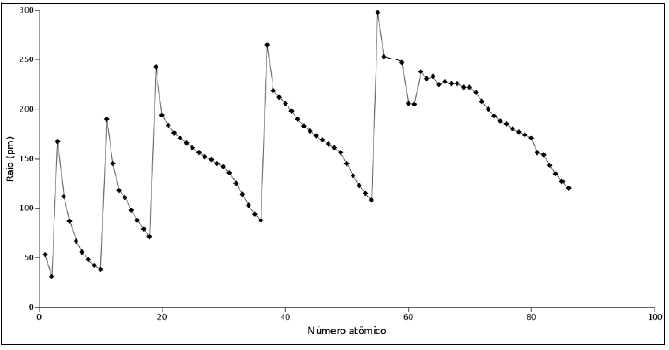
Nesse gráfico, os pontos máximos e mínimos representam, respectivamente:
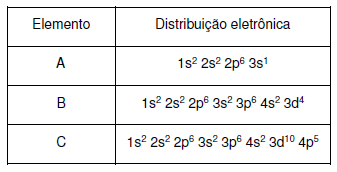
Considerando os dados da tabela e a classificação
periódica dos elementos, indique a afirmativa
incorreta.
I. Ao tornar-se um cátion bivalente seu subnível mais energético passa a ser 3d4 . II. Reage com oxigênio podendo gerar o composto Fe2 O3 , um óxido ácido. III. Apresenta eletronegatividade e eletroafinidade menor que o bromo.
Está(ão) correta(s) somente a(s) afirmativa(s):
I. o ânion presente é formado por um elemento localizado na família dos calcogênios, é tetravalente e que forma o ácido sulfuroso. II. o cátion apresenta raio atômico menor que o seu átomo de origem. III.apresenta maiores pontos de fusão e ebulição se comparado aos compostos moleculares. IV.o ânion contém subnível mais energético 3p4 e une-se ao alumínio formando um composto com fórmula semelhante ao Al 2 O3 . V. o cátion é formado por um elemento menos eletronegativo e de menor energia de ionização que o elemento Se.
Estão corretas as afirmações:
