Questões de Vestibular
Comentadas sobre transformações químicas em química
Foram encontradas 249 questões
NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
( ) A amônia é classificada como um composto orgânico heterogêneo, pois apresenta o heteroátomo nitrogênio em sua estrutura.
( ) É quimicamente impossível obter-se ácido nítrico a partir da amônia, tendo em vista que esta ultima é uma base.
( ) Fritz Haber foi devidamente reconhecido como um importante químico para o mundo em seu tempo, chegando a ser congratulado em 1918 com o premio Nobel de química, devido à grande contribuição com a obtenção do Zyklon B e de outras substâncias de aplicações semelhantes.
( ) Uma grande importância da amônia nos tempos de Haber, assim como é ainda hoje, foi sua aplicação para a produção de produtos essenciais aos humanos, como os fertilizantes, hoje tão importantes para a produção de alimentos no mundo.
( ) O processo de produção da amônia desenvolvido por Haber e aperfeiçoado por Bosch teve influência direta na Primeira Guerra Mundial chegando a prolongá-la.
Indique a seqüência correta

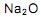 e NaOH, o sódio possui
e NaOH, o sódio possui 




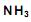 produzido a partir de 28 kg de
produzido a partir de 28 kg de 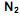 é:
é: 
(Dado: 1 mol equivale a 6.1023 moléculas.)

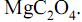 Nessa reação os produtos da decomposição são CO,
Nessa reação os produtos da decomposição são CO, 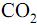 e MgO (massa molar 40 g/mol). Neste gráfico são apresentados os valores da massa da amostra em função da temperatura.
e MgO (massa molar 40 g/mol). Neste gráfico são apresentados os valores da massa da amostra em função da temperatura.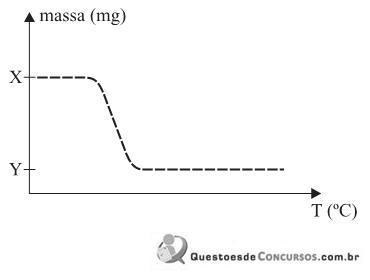
Se a diferença entre as massas X e Y no gráfico for 576 mg, o valor de Y e a porcentagem de perda da massa da reação de decomposição térmica do oxalato de magnésio são, respectivamente,
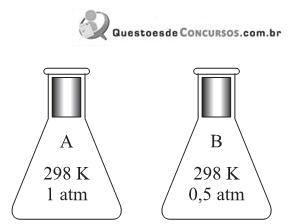
Sobre esses gases, são feitas as seguintes afirmações:
I. O frasco A apresenta o dobro de moléculas em relação ao frasco B.
II. O número de átomos do frasco B é o dobro do número de átomos do frasco A.
III. Ambos os frascos, A e B, apresentam a mesma massa.
IV. Considerando que a reação ocorreu por completo, o frasco C ainda contém gás oxigênio.
São corretas as afirmações



