Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Considere: O sistema adiabático, uma combustão completa a 1200 oC e que os gases gerados são gases ideais. Dados: R = 0,082 atm.L.K-1 .mol-1 ; Massa Molar (C6H12O6) = 180 g/mol.
A pressão interna do recipiente no momento exato da combustão da amostra é de:

(Álvaro M. Barcelos. Propriedades Químicas. Adaptado.)
A equação química que representa o fenômeno ilustrado e a propriedade periódica relacionada a esse efeito são, respectivamente:
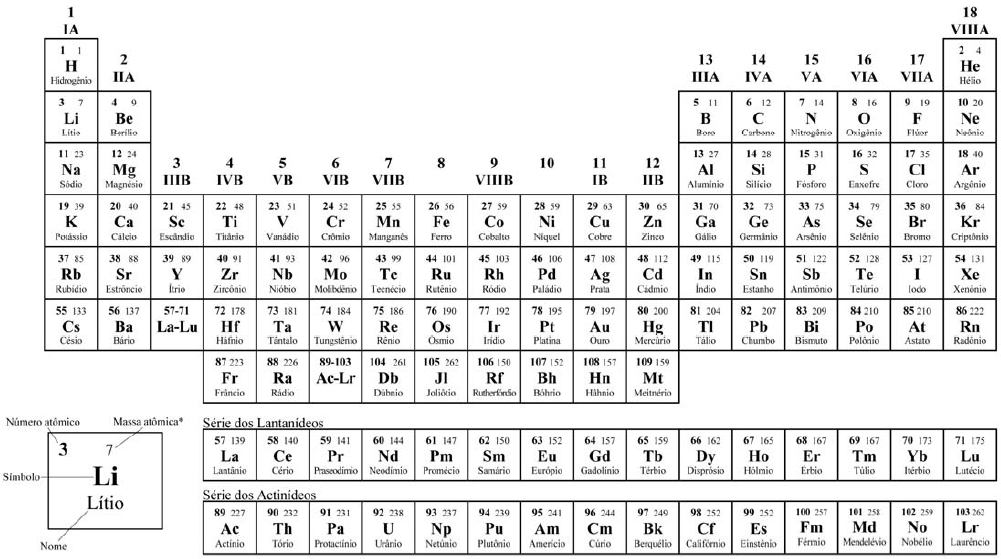
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Com o auxílio das informações a seguir, sobre três dos elementos do Grupo 1 da Tabela Periódica, assinale a alternativa correta.
Elementos Raio atômico (nm) 1.ª Energia de Ionização (kJ/mol)
Li 0,123 520,0
Na 0,157 496,0
K 0,203 419,0

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Com o auxílio das informações a seguir, sobre três dos elementos do Grupo 1 da Tabela Periódica, assinale a alternativa correta.
Elementos Raio atômico (nm) 1.ª Energia de Ionização (kJ/mol)
Li 0,123 520,0
Na 0,157 496,0
K 0,203 419,0

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Com o auxílio das informações a seguir, sobre três dos elementos do Grupo 1 da Tabela Periódica, assinale a alternativa correta.
Elementos Raio atômico (nm) 1.ª Energia de Ionização (kJ/mol)
Li 0,123 520,0
Na 0,157 496,0
K 0,203 419,0

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Com o auxílio das informações a seguir, sobre três dos elementos do Grupo 1 da Tabela Periódica, assinale a alternativa correta.
Elementos Raio atômico (nm) 1.ª Energia de Ionização (kJ/mol)
Li 0,123 520,0
Na 0,157 496,0
K 0,203 419,0
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando o raio atômico e o potencial de ionização dos elementos químicos na tabela periódica, em função de seus respectivos números atômicos, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando o raio atômico e o potencial de ionização dos elementos químicos na tabela periódica, em função de seus respectivos números atômicos, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando o raio atômico e o potencial de ionização dos elementos químicos na tabela periódica, em função de seus respectivos números atômicos, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando o raio atômico e o potencial de ionização dos elementos químicos na tabela periódica, em função de seus respectivos números atômicos, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando o raio atômico e o potencial de ionização dos elementos químicos na tabela periódica, em função de seus respectivos números atômicos, assinale o que for correto.
