Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Mineral Composição Massa molar (g/mol)
goethita Fe2O3 . H2O 178 hematita Fe2O3 160
pirita FeS2 120
siderita FeCO3 116
Os minerais que apresentam maior e menor porcentagem em massa de ferro são, respectivamente,
O íon  e o átomo
e o átomo 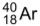 apresentam o mesmo número
apresentam o mesmo número
(www.jornaldaciencia.org.br. Adaptado.)
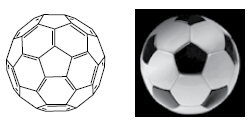
No texto são citados dois_________________ do elemento carbono. No C60, cada átomo de carbono faz____________________ligações sigma.
As lacunas do texto são preenchidas, correta e respectivamente, por
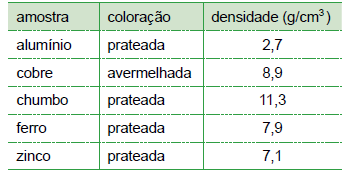
Após constatar que os grupos identificaram corretamente os metais, o professor fez as seguintes observações:
O metal do grupo 1 tinha coloração avermelhada. O metal do grupo 2 tinha menor densidade dentre os metais do experimento. O metal do grupo 3 tinha massa = 39,5 g e a proveta utilizada por esse grupo tinha volume de 25 mL com água e de 30 mL com água mais amostra. O metal do grupo 4 tinha maior densidade que o do grupo 5.
A amostra recebida pelo grupo 5 foi a do metal
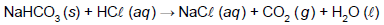
Considerando R = 0,08 atm∙L∙K–1 ∙mol–1 , o volume de gás carbônico, em mL, que pode ser coletado a 300 K e 1,5 atm a partir de 0,01 mol de bicarbonato de sódio é
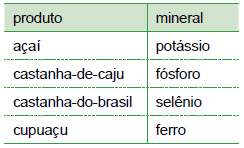
Dentre os elementos químicos indicados na tabela, aquele que apresenta a 1.a energia de ionização mais elevada e o que apresenta maior raio atômico são, respectivamente, os que constituem
Com base nessas informações e nos conhecimentos de Química, é correto afirmar:
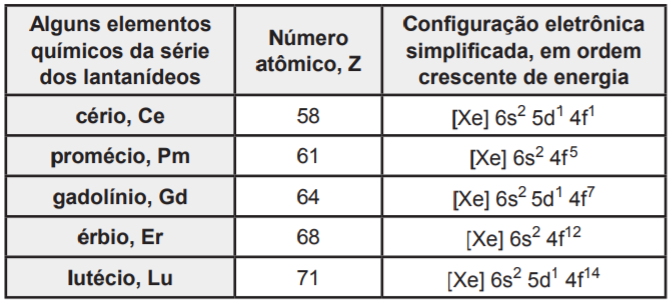
SILVEIRA, Evanildo da. O ouro do século XXI. Planeta. São Paulo: Três, a. 45, e. 533, ago. 2017, p. 36-39. Adaptado.
Considerando-se as informações e as propriedades dos elementos químicos, é correto afirmar:
Na2CrO4(aq) + PbAc2(aq) → 2 NaAc(aq) + PbCrO4(s)
A reação de obtenção do PbCrO4 é classificada como: