Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Considere os dados constantes dos gases ideais: R = 0,082 atm.L/mol.K Massa molar N2: 28 g/mol
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
Considere a reação entre o ácido ortofosfórico e o hidróxido de cálcio abaixo e assinale a alternativa correta que apresenta o composto X formado e o valor de n conforme a estequiometria da reação balanceada.
2H3PO4 + nCa(OH)2 → X + 6H2O
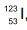 , e iodo-131,
, e iodo-131, 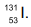 (http://www.cnen.gov.br/radiofarmacos. Adaptado)
(http://www.cnen.gov.br/radiofarmacos. Adaptado)
Os átomos de iodo-123 e iodo-131 possuem
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
Considerando as substâncias mencionadas acima, é correto afirmar que
A sensação refrescante dos refrigerantes é
devida à solubilidade do gás carbônico que é
introduzido na etapa de envasamento. A afirmação “a
solubilidade de um gás em um líquido é proporcional
à pressão do gás sobre a solução”, que pode ser
qualitativamente compreendida dentro da teoria
cinético-molecular, é atribuída a
No nosso cotidiano, há muitas reações
químicas envolvidas, como por exemplo, no preparo
de alimentos, na própria digestão destes alimentos
por nosso organismo, na combustão nos automóveis,
no aparecimento da ferrugem, na fabricação de
remédios, etc. Com relação às reações químicas,
assinale a afirmação correta.
Segundo Sam Kean, no livro A Colher que
Desaparece, Nabucodonosor II da Babilônia (632
a.C. - 562 a.C.) usou uma mistura de chumbo e
antimônio para pintar as paredes de seu palácio de
amarelo e, pouco depois, enlouqueceu em
consequência da inalação do material utilizado. Sobre
o chumbo e o antimônio, marque a única afirmação
FALSA.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
( ) Sua distribuição eletrônica é [Kr] 4f14 5d10 6s26p4 . ( ) Trata-se de um elemento transurânico. ( ) Sua radiação pode ser detida por uma folha de papel. ( ) Só é letal quando ingerido ou inalado. ( ) É mais eletronegativo do que o selênio e o telúrio.
A sequência correta, de cima para baixo, é:
