Questões de Vestibular
Sobre transformações químicas em química
Foram encontradas 1.209 questões
Considere as seguintes afirmativas: I. A cana-de-açúcar é uma planta que pertence ao gênero Saccharum, família Poaceae, utilizada principalmente como matéria-prima para a produção de açúcar e etanol (álcool etílico). II. O etanol se forma na fermentação alcoólica de açúcares, como a glicose, pelo microrganismo (levedura) Saccharomyces cerevisiae, conforme a reação simplificada: C6H12O6 → 2 C2H6O + 2 CO2. III. Os coeficientes estequiométricos para a reação de combustão completa do etanol x C2H6O(l) + y O2(g) → w CO2(g) + z H2O(l), são: x = 1, y = 3, w = 2 e z = 3. IV. Na combustão completa de um mol de etanol ocorre a liberação de 402 kJ de energia.
Dados: Entalpia padrão de formação (ΔH0 f), em kJ·mol-1 , para: C2H6O(l) = -278; CO2(g) = -394 e H2O(l) = -286
Estão corretas?
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
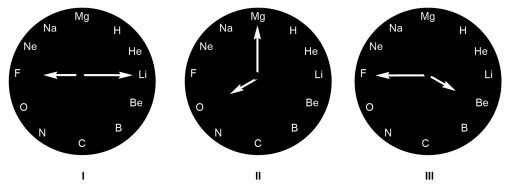
As substâncias neutras formadas a partir da leitura das horas marcadas nos relógios I, II e III são, respectivamente:
O elemento químico arsênio (As) é um metaloide encontrado naturalmente no meio ambiente, sendo as erupções vulcânicas uma de suas principais fontes. Dentre os diversos minerais que contêm arsênio, a arsenopirita (FeAsS) é o mais comum. Esse elemento também pode ser encontrado em alimentos como peixes e crustáceos, e também na cerveja e no vinho branco. Porém, a maior contaminação no homem ocorre por ingestão de água contaminada. Compostos de arsênio foram amplamente utilizados na agricultura como pesticidas. No ramo da medicina veterinária é utilizado como antiparasitário e como aditivo em ração animal. Seu uso também está presente nas indústrias de eletrônicos, como clarificador de vidros e na conservação da madeira.
Analise as afirmativas em relação às informações, no quadro acima.
I. O elemento arsênio pode apresentar estados de oxidação +3 e -3.
II. O raio atômico do elemento arsênio é maior do que o elemento alumínio.
III. O elemento arsênio pode realizar três ou cinco ligações covalentes.
Assinale a alternativa correta.
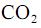 com
com 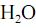 , fotocatalisada, resulte, exclusivamente, na formação de
, fotocatalisada, resulte, exclusivamente, na formação de  e
e 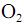 e que a densidade do
e que a densidade do 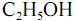 seja igual a 0,80 g/mL, calcule, em litros, o volume de
seja igual a 0,80 g/mL, calcule, em litros, o volume de 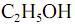 que seria formado a partir de 100,0 kg de
que seria formado a partir de 100,0 kg de 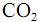 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários.
. Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários. 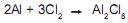
Pode-se afirmar que o reagente limitante, quando 20,0 g de Al e 30,0 g de Cl 2 são usados, e a massa em grama de cloreto de alumínio, teoricamente formada, são, respectivamente,

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.
Caso uma solução contendo NaOH reaja com o alumínio metálico contido em um recipiente e produza o aluminato (AlO33- ), outro produto dessa reação será um gás explosivo, o hidrogênio.