Questões de Vestibular de Química - Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Foram encontradas 59 questões

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
O lança-perfume é uma droga inalante consumida principalmente no Carnaval. É constituído por solventes voláteis que, quando inalados, são levados, via corrente sanguínea, para todo o organismo. Por induzir a produção de adrenalina no organismo, a droga acelera a frequência cardíaca, proporcionando sensação de euforia e desinibição, ao mesmo tempo em que confere
perturbações auditivas e visuais, perda de autocontrole e visão confusa. O cloreto de etila
 e o éter dietílico
e o éter dietílico  , componentes principais do lança-perfume, podem ser sintetizados a partir do
, componentes principais do lança-perfume, podem ser sintetizados a partir do  , de acordo com as
, de acordo com asreações a seguir.

Considerando as reações acima e os valores de entalpias padrão de
formação —
 — a 25 ºC, apresentados na tabela, julgue os itens seguintes.
— a 25 ºC, apresentados na tabela, julgue os itens seguintes. 
Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
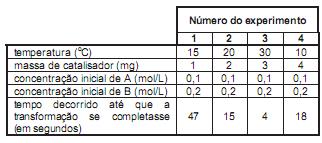
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
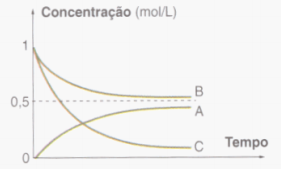
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.

A molécula de sacarose, em contato com a água, sofre uma
reação na qual se degrada em moléculas de glicose e frutose,
conforme o esquema acima. Essa reação, conhecida como reação de
inversão da sacarose, é catalisada em meio ácido. A sacarose desvia
o plano da luz polarizada para a direita, e uma mistura equimolar de
glicose e frutose é desviada para a esquerda, podendo o andamento
da reação ser acompanhado por intermédio de um polarímetro, que
mede o desvio da luz polarizada. A figura a seguir apresenta, de
forma esquemática, as curvas de energia potencial para as reações
catalisada e não catalisada de inversão da sacarose.

A partir dessas informações, julgue os próximos itens.
NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
Na tabela a seguir, são apresentadas informações contidas na bula de comprimidos sólidos de ibuprofeno.
cada comprimido contém
ibuprofeno____|___ 300 mg
excipientes ___|___ ácido cítrico, benzoato de sódio,dióxido de titânio e amido
Assinale a opção que apresenta o gráfico que melhor representa a variação da temperatura em função do tempo para um comprimido que tenha a composição mostrada na tabela e tenha sido macerado e aquecido.
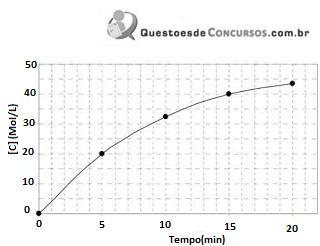
Considerando-se que a curva a seguir represente a variação da concentração de C em função do tempo para a reação química A + 3B ? 2C, é correto afirmar que, no intervalo de 0 a 5 min, a velocidade média da reação é 2,0 mol/L min.
( ) O processo que ocorre no cano de descarga dos veículos automotivos é uma catálise homogênea.
( ) Óxidos de nitrogênio, oriundos das descargas dos veículos, são responsáveis pela névoa fotoquímica.
( ) O conversor catalítico oxida o CO e hidrocarbonetos não queimados, transformando-os em dióxido de carbono e água.
( ) O conversor catalítico reduz os óxidos de nitrogênio a nitrogênio gasoso.
( ) Os conversores catalíticos eliminam totalmente a poluição atmosférica causada pelos gases liberados na descarga dos veículos automotivos.
A sequência correta, de cima para baixo, é
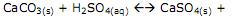
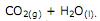 A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.
A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato. 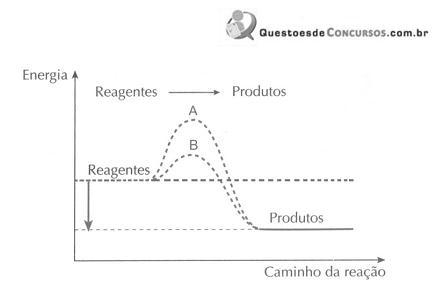
Analisando o diagrama, pode-se afirmar que:

I. Na reação de hidrogenação da quinona temos cetonas sendo convertidas em fenóis pela quebra da ligação C=O, seguida da adição de hidrogênio. Tanto o carbono quanto o oxigênio de cada carbonila recebem um átomo de hidrogênio.
II. Na reação de oxidação temos um álcool sendo convertido em um aldeído, e a água é um dos produtos dessa reação.
III. A quinona participa do processo de obtenção do Peróxido de Hidrogênio como uma substância catalisadora, podendo ser recuperada para a produção de mais H2 O2 .
IV. O peróxido de hidrogênio (H2 O2 ) é uma substância letal aos humanos, mesmo em pequenas quantidades.
Está(ão) correta(s) a(s) alternativa(s):
I - No instante t = 60 s, a velocidade da produção do gás hidrogênio é maior que a velocidade de consumo de Mg (em mols/s).
II - Em qualquer instante após o início da reação, a quantidade de matéria (mol) produzida de gás hidrogênio é o dobro da consumida de ácido clorídrico.
III - A massa de gás hidrogênio produzida é sempre menor que a massa de ácido consumida, em qualquer instante.
Está(ão) correto(s):
Sabe-se que, no equilíbrio, a velocidade de formação dos produtos, V, e a velocidade inversa, de formação dos reagentes, V’ , são iguais:
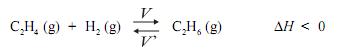
Foram realizados dois experimentos envolvendo essa reação, com apenas uma diferença: um, na presença de catalisador; o outro, na ausência deste.
Comparando-se esses dois experimentos, é CORRETO afirmar que, na reação catalisada, aumenta

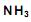 produzido a partir de 28 kg de
produzido a partir de 28 kg de 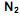 é:
é: 



