Questões de Vestibular de Química - Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Foram encontradas 270 questões
Uma certa espécie química A, quando em solução, reage rapidamente com oxigênio molecular dissolvido e é degradada por ele. A velocidade dessa reação segue a lei da velocidade v = k[A].
O gráfico que representa de forma adequada a relação entre a concentração da espécie A em solução com o decorrer da reação é:
Deixou-se o NO(g) borbulhar até que fossem acrescidos ao tubo 4 mL desse gás. Após cessar o fluxo de NO(g), o tubo foi mantido imerso na posição vertical, de modo que seu volume pudesse variar, mantendo a pressão em seu interior igual à pressão exterior, mas sem escape de gás. Após certo tempo, o gás dentro do tubo adquire cor castanha, em função da seguinte reação: 2NO(g) + O2(g)
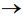 2NO2 (g)
2NO2 (g)
A respeito desse experimento, identifique as afirmativas abaixo como verdadeiras (V) ou falsas (F):
( ) O NO(g) é reagente limitante da reação. ( ) Em relação à condição imediata depois de cessado o fluxo, o volume de gás dentro do tubo irá diminuir após o gás ficar castanho. ( ) Em relação à condição imediata depois de cessado o fluxo, a pressão parcial de N2(g) dentro do tubo irá aumentar após o gás ficar castanho. ( ) O valor de pH da água na região A (dentro do tubo) irá diminuir após o gás se tornar castanho.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A adição de um catalisador na reação II, em equilíbrio, favorece o rendimento em H2
.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Como as ordens de reação estão sempre de acordo com sua estequiometria, a lei cinética da reação II
é v= k[CO].[H2O].
INSTRUÇÃO: Para responder à questão, analise a fórmula e o texto abaixo, que contém lacunas.
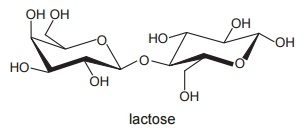
A lactose é um _________ encontrado em diversos tipos de leite e, junto com as gorduras, é uma das fontes de energia para filhotes de mamíferos. A estrutura dessa molécula apresenta numerosos grupos funcionais característicos dos _________, que conferem a ela boa solubilidade em água. A digestão da lactose exige uma enzima específica, a lactase, que normalmente os filhotes de mamíferos possuem, mas não os adultos. A lactase é uma proteína que age como _________, acelerando a reação de quebra da molécula da lactose. A falta dessa enzima no organismo origina a intolerância à lactose, que acomete parte da população.
Assinale a alternativa com as palavras que preenchem
corretamente as lacunas.