Questões de Vestibular de Química - Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Foram encontradas 270 questões
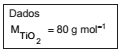
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
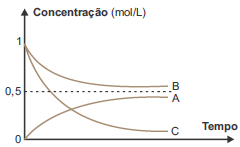
A respeito do experimento, foram feitas algumas afirmações:
I. A e B são reagentes e C é o produto da reação estudada. II. A reação química estudada é corretamente representada pela equação: B + 2 C → A III. Não houve consumo completo dos reagentes, sendo atingido o equilíbrio químico. IV. A constante de equilíbrio dessa reação, no sentido da formação de A, nas condições do experimento é menor do que 1.
Estão corretas apenas as afirmações:
A tabela a seguir sintetiza os dados experimentais obtidos de um estudo cinético da reação.

A expressão da equação da velocidade nas condições dos experimentos é
O titânio é obtido a partir do mineral rutilo (TiO2 ) em duas etapas: a primeira, formando cloreto de titânio a 1000 °C (Equação I); e a segunda, usando magnésio para promover a redução e obter o titânio (Equação II).
TiO2(s) + 2 C(s) + 2 Cl2(g) → TiCl4(g) + 2CO(g) (Equação I)
TiCl4(l) + 2 Mg(s) → Ti(s) + 2 MgCl2(l) (Equação II)
Considere que 6,0 ton de minério produziram massa igual a 2,4 ton de Ti, considerando as reações completas. A porcentagem (valor arredondado mais próximo) de TiO2 originalmente no minério é: