Durante uma transformação química as concentrações das subst...
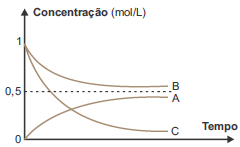
A respeito do experimento, foram feitas algumas afirmações:
I. A e B são reagentes e C é o produto da reação estudada. II. A reação química estudada é corretamente representada pela equação: B + 2 C → A III. Não houve consumo completo dos reagentes, sendo atingido o equilíbrio químico. IV. A constante de equilíbrio dessa reação, no sentido da formação de A, nas condições do experimento é menor do que 1.
Estão corretas apenas as afirmações:
Comentários
Veja os comentários dos nossos alunos
I – Falsa.
De acordo com o gráfico, B e C são consumidos e A é formado ao longo do tempo; logo, B e C são reagentes e A é produto da reação.
II – Verdadeira.
De acordo com o gráfico, é consumido o dobro da quantidade de C em relação ao que foi consumido de B; logo, a proporção estequiométrica entre C e B é de 2 : 1. Como a quantidade formada de A é igual à consumida de B, conclui-se que o coeficiente estequiométrico de A é igual ao de B, ou seja, a equação balanceada deve ser: 1B + 2 C ⇒ 1 A.
III – Verdadeira.
Não há consumo total de nenhum reagente, pois a reação é reversível e atinge o estado de equilíbrio.
IV – Falsa.
A constante do equilíbrio será maior que 1; portanto, Kc > 1.
(Anglo)
com a vírgula o item III é (deveria) falso, sem a vírgula é verdadeiro.
A banca esqueceu de rever essa incoerência
Inícío - Equilíbrio
A-> 0 - 0,4
B-> 1 - 0,6
C-> 1 - 0,2
Keq = [A]/[B].[C]^2
Keq = 0,4/0,6.(0,2)^2
Keq = 16,67
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo
