O titânio é obtido a partir do mineral rutilo (TiO2 ) em du...
O titânio é obtido a partir do mineral rutilo (TiO2 ) em duas etapas: a primeira, formando cloreto de titânio a 1000 °C (Equação I); e a segunda, usando magnésio para promover a redução e obter o titânio (Equação II).
TiO2(s) + 2 C(s) + 2 Cl2(g) → TiCl4(g) + 2CO(g) (Equação I)
TiCl4(l) + 2 Mg(s) → Ti(s) + 2 MgCl2(l) (Equação II)
Considere que 6,0 ton de minério produziram massa igual a 2,4 ton de Ti, considerando as reações completas. A porcentagem (valor arredondado mais próximo) de TiO2 originalmente no minério é:
Comentários
Veja os comentários dos nossos alunos
D) 67
A reação global indica 1 mol de TiO2 para 1 mol de Ti. Assim, 2,4 ton de Ti equivalem a 50.000 mol de Ti (nTi = 2400.000 g/48 g mol-1 = 50.000 mol).
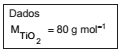
Ou seja, tem-se uma quantidade equivalente de TiO2. Logo, a massa de TiO2 no minério é 50.000 mol x 80 g mol-1 = 4.000.000 g ou 4,0 ton.
O que, em termos porcentuais, é (4,0/6,0) x 100 = 66,7% ou, aproximando, 67%.
Fonte:
https://www.puc-rio.br/vestibular/repositorio/provas/2017/download/gabaritos/Vest2017_gabarito_G2_20161010_v2.pdf
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo