Questões de Vestibular UNB 2024 para Prova de Conhecimentos III - 2° dia
Foram encontradas 39 questões
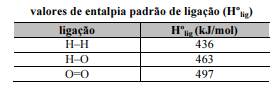
A entalpia-padrão de combustão (ΔHºc) pode ser chamada, também, de calor de combustão.

A reação de combustão do gás hidrogênio libera uma quantidade de energia superior a 230 kJ/mol.

A entalpia-padrão de formação (ΔHºf) é nula para substâncias simples, desde que estejam no estado-padrão, no estado físico e na forma alotrópica mais estáveis.

Reações de combustão são facilmente reversíveis.

A reação de combustão do gás hidrogênio gera água na forma de vapor; se a reação gerasse água na forma líquida, a liberação de energia seria a mesma.

A entalpia de um sistema é uma grandeza, expressa em unidade de energia, que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo a pressão constante.

A entalpia de vaporização caracteriza-se por ser sempre positiva.
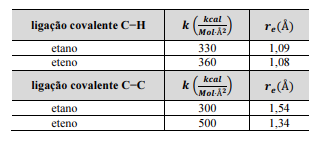
A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.

Para a ligação C−H esticada 0,02 Å além da sua distância de equilíbrio, a energia potencial em um eteno será menor que em um etano.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse caso, a relação entre o produto de solubilidade (Kps) do CoCl2 e sua solubilidade molar (cs) seriam corretamente representados por
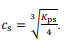
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço indica que a decomposição do complexo [Co(NH3)6] 2+ é favorecida.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O nitrogênio é mais propenso a formar ligações duplas e triplas que o fósforo, devido ao seu menor raio atômico e à sua maior eletronegatividade.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Conforme o princípio de Le Châtelier, caso a reação esteja em equilíbrio, um aumento na concentração de amônia deslocaria o equilíbrio no sentido da formação do complexo.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O número de átomos de cobalto em 235,6 g de cobalto metálico é superior a 2,6 × 1024.
Faça o que se pede no item que é do tipo D.
Explique por que o ligante amônia influencia a geometria molecular do [Co(NH3)6] 2+ e por que o meio básico é essencial para a formação do complexo.
TipoD
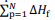 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 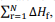 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.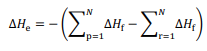
Considere que um dos compostos avaliados no estudo em tela tenha sido o FOX-7, cuja fórmula mínima é CH2N2O2 e que apresenta massa molar igual a 148 g/mol. Nessa situação, é correto concluir que a fórmula molecular do FOX-7 é C2H4N4O4.
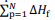 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 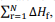 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.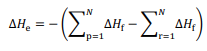

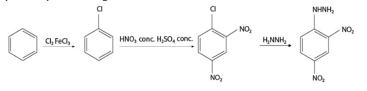
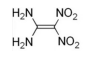
A fórmula estrutural do composto 1,1-diamino-2,2-dinitroeteno é corretamente apresentada na figura a seguir.
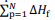 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 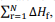 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.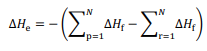

No que se refere à rota sintética da DNPH, é correto afirmar que o halogênio ligado ao anel benzênico orienta preferencialmente a segunda substituição eletrolítica nas posições orto e para.
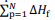 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 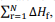 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.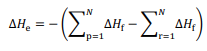

Considere que a entalpia de formação (ΔHf) do RDX seja +83,82 kJ/mol e que os valores de ΔHf para CO, H2O e N2 sejam, respectivamente, −111,8 kJ/mol, −240,6 kJ/mol e 0,0 kJ/mol. Nessas condições, o calor liberado pela detonação de 1 kg de RDX será inferior a 5.000 kJ.
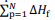 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 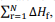 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.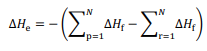

Assumindo-se que a temperatura do meio reacional aumente 25 °C com a explosão, que a pressão seja constante e que o rendimento da reação tenha sido de 100%, conclui-se que o volume total de gases produzidos na decomposição do RDX será inferior a 0,95 L por grama de explosivo.