A partir dessas informações e considerando que o volume mola...
Próximas questões
Com base no mesmo assunto
Ano: 2024
Banca:
CESPE / CEBRASPE
Órgão:
UNB
Prova:
CESPE / CEBRASPE - 2024 - UNB - Prova de Conhecimentos III - 2° dia |
Q3107620
Química
Texto associado
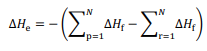
O desenvolvimento de um modelo de aprendizado de
máquina permitiu a identificação de novos compostos explosivos.
O modelo foi utilizado com dados termoquímicos e modelagem
de explosões para prever o calor de explosão (ΔHe), considerada
a propriedade chave para a avaliação da performance energética
de compostos. O ∆He é relacionado às entalpias-padrão de
formação (∆Hf) dos participantes da reação de acordo com a
equação a seguir, em que 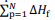 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 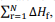 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.
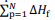 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 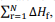 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.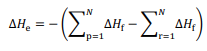
A explosão do composto RDX (C3H6N6O6) ocorre por
meio da reação a seguir representada.
C3H6N6O6 (s) → 3 CO (g) + 3 H2O (g) + 3 N2 (g)
A partir de uma base de 140 milhões de moléculas, o
modelo identificou centenas de compostos com desempenho
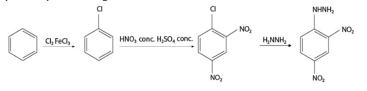
equivalente ou superior ao TNT, tais como nitrato de ureia,
2,4-dinitrofenil-hidrazina (DNPH) e 1,1-diamino-2,2-dinitroeteno.
A rota sintética de obtenção do composto DNPH é representada
pelo esquema a seguir.

A partir dessas informações e considerando que o volume molar
de um gás ideal nas CNTP seja 22,4 L e que todos os gases se
comportem de forma ideal, julgue o item que se segue.
Considere que um dos compostos avaliados no estudo em tela tenha sido o FOX-7, cuja fórmula mínima é CH2N2O2 e que apresenta massa molar igual a 148 g/mol. Nessa situação, é correto concluir que a fórmula molecular do FOX-7 é C2H4N4O4.
Considere que um dos compostos avaliados no estudo em tela tenha sido o FOX-7, cuja fórmula mínima é CH2N2O2 e que apresenta massa molar igual a 148 g/mol. Nessa situação, é correto concluir que a fórmula molecular do FOX-7 é C2H4N4O4.