Questões de Vestibular UFAC 2011 para Vestibular, PRIMEIRO DIA - CADERNO A
Foram encontradas 10 questões
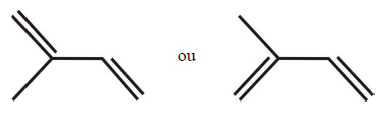
A respeito dessa molécula, é correto afirmar que:
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio.

Sobre tais reações, pode-se dizer que:
Concentração de ácido acético: 6,0% m/V
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?” As seguintes informações foram fornecidas pelo professor:
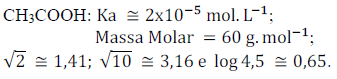
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
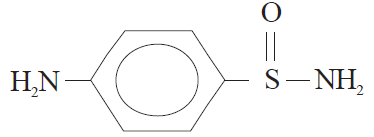
Algumas sulfonamidas podem ser potencialmente carcinogênicas e ainda podem causar efeitos colaterais, como reações alérgicas ou tóxicas em algumas pessoas.
Analisando-se os grupos funcionais presentes na p-amino benzeno sulfonamida, pode-se dizer que está presente a função:
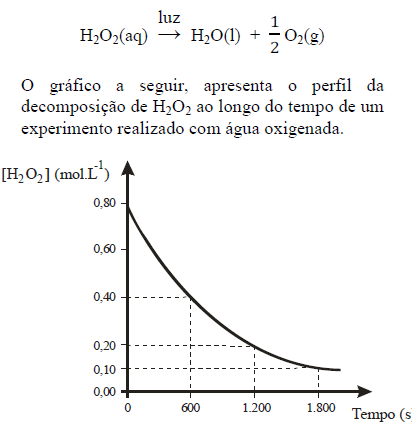
Considerando a reação química e o gráfico apresentados, e ainda que o tempo inicial é igual a zero, é correto afirmar que:
Fe(s) + 2 HCl(aq) → FeCl2(aq) + H2(g)
Então, na temperatura de 25 ºC e pressão de 1 atm, o volume de gás hidrogênio, considerado gás ideal, para inflar o balão foi de aproximadamente:
Dados:
Massas Molares (g.mol-1): H = 1,0; Cl = 35,5 e Fe = 56,0; R = 0,082 L.atm.K-1.mol-1 (Constante Universal dos Gases); T (K) = T(ºC) + 273.
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
A tabela a seguir, mostra as propriedades de cinco amostras enumeradas de I a V.
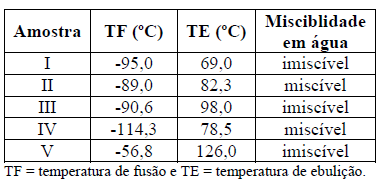
Considerando as substâncias: etanol, 2-propanol, n-hexano, n-heptano e n-octano, a opção que apresenta a identificação correta das amostras, na ordem de I a V, é:
N2(g) + 3 H2(g) ⇌ 2 NH3(g); ∆H < 0
Contudo, considerando em um determinado instante que o sistema esteja em equilíbrio, a produção de amoníaco será aumentada se:
De acordo com o texto, a seqüência de fórmulas moleculares dos ácidos destacados, considerando a ordem de leitura, é: