Questões de Vestibular MACKENZIE 2010 para Vestibular
Foram encontradas 7 questões
A adição de sulfato de alumínio é o primeiro passo desse processo e pode ser representado pela equação química NÃO BALANCEADA abaixo.
Aℓ2(SO4)3 + H2O
 Aℓ(OH)3 + H2SO4
Aℓ(OH)3 + H2SO4
Assim, de acordo com a equação dada, de adição de sulfato de alumínio, é correto afirmar que
Dado: massa molar em (g/mol) H = 1, O = 16, Aℓ = 27 e S = 32.
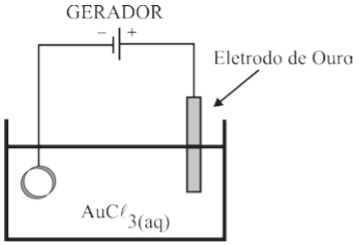
Dados: Au = 197 g/mol e 1 mol de elétrons = 9,6∙104 C.
A respeito do processo eletroquímico ilustrado acima, considere as afirmações dadas, de I a V.
I. O anel foi colocado no ânodo da cuba eletrolítica.
II. Ao passar uma corrente de 3 ampères, durante 16 minutos, há a deposição de aproximadamente 2,0 g de ouro sobre o anel.
III. No polo positivo ocorre a reação Au(s) → Au3+(aq) + 3 e-.
IV. No cátodo da cela eletrolítica ocorre oxidação.
V. No anel ocorre a reação Au3+(aq) + 3 e- → Au(s).
Dessas afirmações, estão corretas, somente
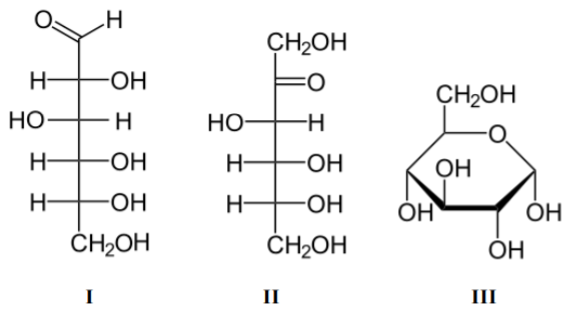
A glicose é um monossacarídeo de grande importância biológica, pois as células a usam como fonte de energia. É um cristal sólido de sabor adocicado, de fórmula molecular C6H12O6, encontrado na natureza na forma livre ou combinada. Juntamente com a frutose, é o carboidrato fundamental na formação do dissacarídeo sacarose. A molécula de glicose pode existir em forma de cadeia aberta ou cíclica, sendo que tais formas permanecem em equilíbrio. Representadas as estrututuras da D-glicose em cadeia aberta (I), D-frutose (II) e D-glicose cíclica (III), respectivamente, é INCORRETO afirmar que
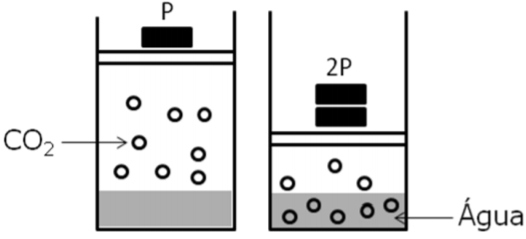
No champanhe, nos vinhos espumantes e nas cervejas, o dióxido de carbono (CO2) é o principal responsável pela formação das bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e de CO2.
Após o engarrafamento, é estabelecido um equilíbrio entre o gás carbônico dissolvido no líquido e o gás que está no espaço sob a rolha ou a tampa.
Considerando as informações do texto, os seus conhecimentos químicos e a figura dada, é INCORRETO afirmar que
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
N2(g) + 3 H2(g)
Com o intuito de favorecer a produção de amônia, foram feitas, no sistema, as intervenções de I a V.
I. Aumento da pressão total do sistema.
II. Aumento da pressão parcial do gás amônia.
III. Diminuição da concentração do gás hidrogênio.
IV. Aumento da concentração do gás nitrogênio.
V. Utilização de um catalisador de ferro metálico.
São eficientes, para esse propósito, apenas as intervenções
As reações que acontecem no interior da bateria estão representadas abaixo.
Ânodo: Pb(s) + HSO4-(aq) + H2O(ℓ) → PbSO4(s) + H3O+(aq) + 2e- Cátodo: PbO2(s) + 3H3O+(aq) + HSO4-(aq) + 2e- → PbSO4(s) + 5H2O(ℓ)
A respeito das baterias de chumbo, considere as afirmações I, II, III e IV.
I. A concentração da solução de ácido sulfúrico utilizada na bateria é de aproximadamente 390 g/L. II. Um derramamento da solução de bateria pode ser neutralizado com uma solução de cloreto de amônio. III. Uma solução de bateria pode ser preparada a partir da diluição de 100 mL de ácido sulfúrico, 18 mol/L, com água pura, até volume final de 1 L. IV. A equação Pb(s) + PbO2(s) + 2H3O+(aq) + 2 HSO4-(aq) → 2 PbSO4(s) + 4H2O(ℓ) representa a reação global que ocorre na bateria.
Dado: massa molar do H2SO4 = 98 g/mol.
Dessas afirmações, estão corretas, apenas