Uma amostra de um composto orgânico foi queimada em atmosfe...
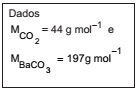
Uma amostra de um composto orgânico foi queimada em atmosfera rica em oxigênio de forma a transformar todo o carbono em gás CO2 . Esse gás foi borbulhado em uma solução de hidróxido de bário, onde todo o CO2 foi precipitado na forma de BaCO3 (ver equação). Se 0,106 g de amostra produziu 0,296 g de BaCO3 , a percentagem (valor mais próximo) de carbono na substância é
CO2(g) + Ba2+(aq) → BaCO3(s)
Comentários
Veja os comentários dos nossos alunos
Resposta: (B) 17
b) CORRETO. nBaCO3 = 0,296/197 = 0,0015 mol, o que equivale a 0,0015 mol de CO2 e que equivale a 0,0015 mol de C, que equivale a uma massa igual a 0,018 g. Ou seja, %C = (0,018/0,106) x 100 = 17%.
Fonte:
https://www.puc-rio.br/vestibular/repositorio/provas/2017/download/gabaritos/Vest2017_gabarito_G4_20161010_v2.pdf
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo