Dados: Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷Cons...
Dados:
Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷
Constante de ionização (Kb) do NH₃= 2 x 10⁻⁵
Constante de ionização (Kw) do H₂O = 1 x 10⁻¹⁴
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Atabela a seguir apresenta afaixa de viragem (mudança de cor) de alguns indicadores ácido base.
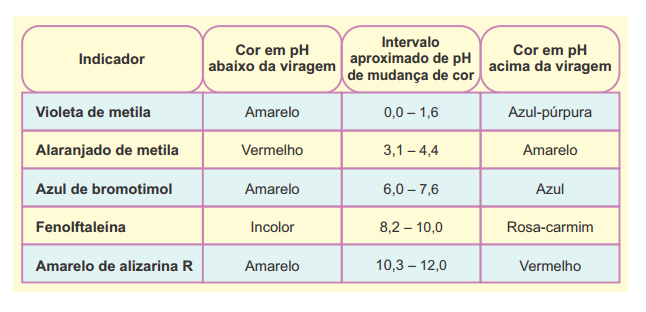
A partir da análise dessa tabela, um técnico executou um procedimento para distinguir algumas soluções.
Para diferenciar uma solução de 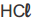 de concentração 1,0 mol.L⁻¹ de uma solução de
de concentração 1,0 mol.L⁻¹ de uma solução de 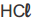 e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
A alternativa que apresenta os indicadores X, Y e Z adequados para cada um dos procedimentos propostos pelo técnico é
Comentários
Veja os comentários dos nossos alunos
Essa questão está errada, na questão publicada pela banca é NH4Cℓ ao invés de HCℓ quando ele usa o indicador Y, de resto a questão está certa
NH3 + H20 ---> NH4+ + OH-
nh3 é uma base.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo
