Questões de Vestibular
Foram encontradas 637 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3
PbCO3(s) + 2 HNO3(aq) ® Pb(NO3)2(aq) + H2O (ℓ) + CO2(g) (Equação 1)
Pb(NO3)2(aq) + H2SO4(aq) ® PbSO4(s) + 2 HNO3(aq) (Equação 2)
Supondo que uma amostra de 0,79 g do mineral tenha produzido 0,84 g de PbSO4, pode-se concluir que a porcentagem em massa de PbCO3 na amostra é, em valores arredondados, de
Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo com a seguinte equação química:
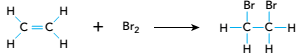
Considere um cilindro de capacidade igual a 10 L, contendo apenas esses hidrocarbonetos em uma mistura com massa igual a 200 g. Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu, formando 940 g de 1,2-dibromoetano.
A concentração inicial de etano, em mol.L–1, no interior do cilindro, corresponde a:

