Questões do Enem
Sobre representação das transformações químicas em química
Foram encontradas 66 questões
As indústrias de cerâmica utilizam argila para produzir artefatos como tijolos e telhas. Uma amostra de argila contém 45% em massa de sílica (SiO2) e 10% em massa de água (H2O). Durante a secagem por aquecimento em uma estufa, somente a umidade é removida.
Após o processo de secagem, o teor de sílica na argila seca será de
Pesquisadores desenvolveram uma nova e mais eficiente rota sintética para produzir a substância atorvastatina, empregada para reduzir os níveis de colesterol. Segundo os autores, com base nessa descoberta, a síntese da atorvastatina cálcica (CaC66H68F2N4O10, massa molar igual a 1 154 g/mol ) é realizada a partir do éster 4-metil-3-oxopentanoato de metila (C7H12O3, massa molar igual a 144 g/mol).
Unicamp descobre nova rota para produzir medicamento mais vendido no mundo. Disponível em: www.unicamp.br. Acesso em: 26 out. 2015 (adaptado).
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de1:1. Simplificadamente, o processo é ilustrado na figura.
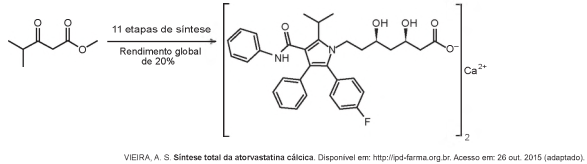
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é
mais próxima de
As abelhas utilizam a sinalização química para distinguir a abelha-rainha de uma operária, sendo capazes de reconhecer diferenças entre moléculas. A rainha produz o sinalizador químico conhecido como ácido 9-hidroxidec-2-enoico, enquanto as abelhas-operárias produzem ácido 10-hidroxidec-2-enoico. Nós podemos distinguir as abelhas-operárias e rainhas por sua aparência, mas, entre si, elas usam essa sinalização química para perceber a diferença. Pode-se dizer que veem por meio da química.
LE COUTEUR, R; BURRESON, J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Rio de Janeiro: Jorge Zahar, 2006 (adaptado).
As moléculas dos sinalizadores químicos produzidas pelas abelhas rainha e operária possuem diferença na
A identificação de riscos de produtos perigosos para o transporte rodoviário é obrigatória e realizada por meio da sinalização composta por um painel de segurança, de cor alaranjada, e um rótulo de risco. As informações inseridas no painel de segurança e no rótulo de risco, conforme determina a legislação, permitem que se identifique o produto transportado e os perigos a ele associados.
A sinalização mostrada identifica uma substância que está sendo transportada em um caminhão.

Os três algarismos da parte superior do painel indicam o “Número de risco”. O número 268 indica tratar-se de um gás (2), tóxico (6) e corrosivo (8). Os quatro dígitos da parte inferior correspondem ao “Número ONU”, que identifica o produto transportado.
BRASIL. Resolução n. 420, de 12/02/2004, da Agência Nacional de Transportes Terrestres (ANTT)/Ministério dos Transportes (adaptado).
ABNT. NBR 7500: identificação para o transporte terrestre, manuseio, movimentação e armazenamento de produtos. Rio de Janeiro, 2004 (adaptado).
Considerando a identificação apresentada no caminhão,
o código 1005 corresponde à substância
Usando um densímetro cuja menor divisão da escala, isto é, a diferença entre duas marcações consecutivas, é de 5,0 x 10-2 g cm-3, um estudante realizou um teste de densidade: colocou este instrumento na água pura e observou que ele atingiu o repouso na posição mostrada.
Em dois outros recipientes A e B contendo 2 litros de água pura, em cada um, ele adicionou 100 g e 200 g de NaCl, respectivamente.
Quando o cloreto de sódio é adicionado à água pura ocorre sua dissociação formando os íons Na+ e Cl-. Considere que esses íons ocupam os espaços intermoleculares na solução.
Nestes recipientes, a posição de equilíbrio do densímetro
está representada em:
O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
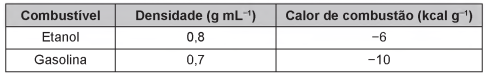
O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
No Brasil, os postos de combustíveis comercializavam uma gasolina com cerca de 22% de álcool anidro. Na queima de 1 litro desse combustível são liberados cerca de 2 kg de CO2 na atmosfera. O plantio de árvores pode atenuar os efeitos dessa emissão de CO2. A quantidade de carbono fixada por uma árvore corresponde a aproximadamente 50% de sua biomassa seca, e para cada 12 g de carbono fixados, 44 g de CO2 são retirados da atmosfera. No Brasil, o plantio de eucalipto (Eucalyptus grandis) é bem difundido, sendo que após 11 anos essa árvore pode ter a massa de 106 kg, dos quais 29 kg são água.
Uma única árvore de Eucalyptus grandis, com as características descritas, é capaz de fixar a quantidade de CO2 liberada na queima de um volume dessa gasolina mais próximo de
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
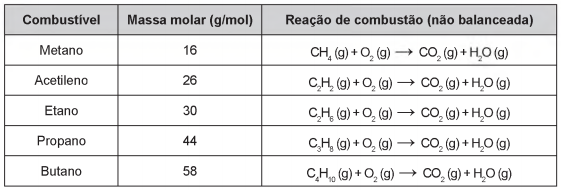
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite
mais CO2 é o
Um estudante construiu um densímetro, esquematizado na figura, utilizando um canudinho e massa de modelar. O instrumento foi calibrado com duas marcas de flutuação, utilizando água (marca A) e etanol (marca B) como referências.
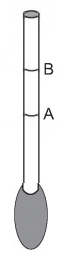
Em seguida, o densímetro foi usado para avaliar cinco amostras: vinagre, leite integral, gasolina (sem álcool anidro), soro fisiológico e álcool comercial (92,8 °GL).
Que amostra apresentará marca de flutuação entre os
limites A e B?
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
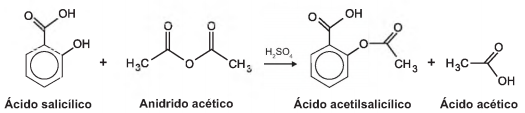
Após a síntese, o AAS é purificado e o rendimento flnal é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do
texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
As emissões de dióxido de carbono (CO2) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2, a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
Climatério é o nome de um estágio no processo de amadurecimento de determinados frutos, caracterizado pelo aumento do nível da respiração celular e do gás etileno (C2H4). Como consequência, há o escurecimento do fruto, o que representa a perda de muitas toneladas de alimentos a cada ano.
É possível prolongar a vida de um fruto climatérico pela eliminação do etileno produzido. Na indústria, utiliza-se o permanganato de potássio (KMnO4) para oxidar o etileno a etilenoglicol (HOCH2CH2OH), sendo o processo representado de forma simplificada na equação:
2KMnO4+3 C2H4+4H2O → 2 MnO2 + 3HOCH2CH2OH + 2KOH
O processo de amadurecimento começa quando a concentração de etileno no ar está em cerca de 1,0 mg de C2H4 por kg de ar.
As massas molares dos elementos H, C, O, K e Mn são, respectivamente, iguais a 1 g/mol, 12g/mol, 16g/mol, 39 g/mol e 55 g/mol.
A fim de diminuir essas perdas, sem desperdício de
reagentes, a massa mínima de KMnO4 por kg de ar é mais
próxima de
Um bafômetro simples consiste em um tubo contendo uma mistura sólida de dicromato de potássio em sílica umedecida com ácido sulfúrico. Nesse teste, a detecção da embriaguez por consumo de álcool se dá visualmente, pois a reação que ocorre é a oxidação do álcool a aldeído e a redução do dicromato (alaranjado) a cromo(lll) (verde) ou cromo(ll) (azul).
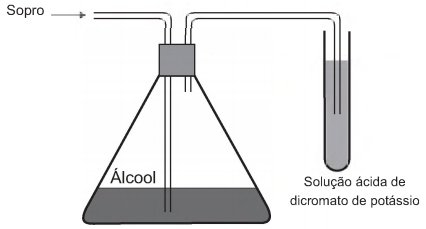
A equação balanceada da reação química que representa esse teste é:
O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90% em massa e densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como

em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH → CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol
foram obtidos a partir de 142,5 g de brometo de metila e
80 g de hidróxido de sódio, é mais próximo de
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como solventes do dióxido de enxofre (SO2 ), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário, por meio de calcinação, e a fixação do SO2 com a formação de um sal de cálcio, como ilustrado pelas equações químicas simplificadas.
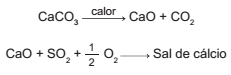
Considerando-se as reações envolvidas nesse processo
de dessulfurização, a fórmula química do sal de cálcio
corresponde a
O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique "livre" e o enxofre se combine com o O2 produzindo SO2 , conforme a equação química:
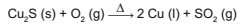
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em
uma reação cujo rendimento é de 80%, a massa, em
gramas, do minério necessária para obtenção do cobre
é igual a
A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
2 ZnS + 3 O2 → 2 ZnO + 2 S02
ZnO + CO → Z n + C02
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol);ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico,em quilogramas, será produzido a partir de 100 kg de esfalerita?