Questões do Enem
Sobre representação das transformações químicas em química
Foram encontradas 66 questões
TiO2 + 2 Cl2 + 2 CO
 TiCI4 + 2 CO2
TiCI4 + 2 CO2 A segunda operação consiste na redução do tetracloreto de titânio, utilizando magnésio metálico:
2 Mg + TiCl4
 2 MgCl2 + Ti
2 MgCl2 + Ti Considere as massas molares:
Cl = 35,5 g/mol ; Ti = 48 g/mol .
Qual a massa de gás cloro necessária para produzir 480 kg de titânio metálico?
Massas molares:

Pesquisa de orçamentos familiares: análise do consumo alimentar pessoal no Brasil. Disponível em: www.biblioteca.ibge.gov.br. Acesso em: 27 nov. 2019 (adaptado)
Ainda que os brasileiros consumam apenas sal light, a massa de sódio ingerida em excesso será mais próxima de

CH3COO− (aq) + 2 H2O (I) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (I)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
A massa de bauxita que deve ser empregada para produzir o alumínio usado na fabricação de um carro desse modelo é mais próxima de
CAVAGIS, A. D. M.; PEREIRA, E. A.; OLIVEIRA, L. C. Um método simples para avaliar o teor de sacarose e CO2 em refrigerantes. Química Nova na Escola, n. 3, ago. 2014 (adaptado).
Entre as duas versões apresentadas, o refrigerante comum possui
Um marceneiro esqueceu um pacote de pregos ao relento, expostos à umidade do ar e à chuva. Com isso, os pregos de ferro, que tinham a massa de 5,6 g cada, acabaram cobertos por uma camada espessa de ferrugem (Fe2O3 ˑ H2O), uma substância marrom insolúvel, produto da oxidação do ferro metálico, que ocorre segundo a equação química:
2 Fe (s) + 3/2 O2 (g) + H2O (l) → Fe2O3 ˑ H2O (s)
Qual foi a massa de ferrugem produzida ao se oxidar a
metade (50%) de um prego?
A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reage formando uma solução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:
4 FeS2 (s) + 15 O2 (g) + 2 H2O (l) → 2 Fe2 (SO4 )3 (aq) + 2 H2SO4 (aq)
Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em
seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol,
respectivamente?
As plantas realizam fotossíntese pela captura do gás carbônico atmosférico e, juntamente com a água e a luz solar, produzem os carboidratos. No esquema está apresentada a equação desse processo, em que as letras x e y representam os coeficientes estequiométricos da reação.
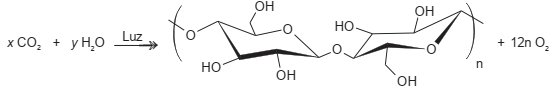
Quais são os valores dos coeficientes x e y da equação balanceada de produção do carboidrato e oxigênio?
O consumo excessivo de sal de cozinha é responsável por várias doenças, entre elas a hipertensão arterial. O sal rosa é uma novidade culinária pelo seu baixo teor de sódio se comparado a de outros sais. Cada 1 g desse sal contém cerca de 230 mg de sódio contra os cerca de 400 mg de sódio encontrados nessa mesma quantidade de um sal de cozinha tradicional. Estima-se que no Brasil a dose diária de consumo de sal de cozinha seja de 12 g, e a dose máxima recomendada é de menos de 5 g por dia. Considere a massa molar do sódio igual a 23 g/mol.
MILL, J. G. et al. Estimativa do consumo de sal pela população brasileira:
resultado da Pesquisa Nacional de Saúde 2013. Rev. Bras. Epidemiol.,
n. 22, 2019 (adaptado).
Considerando-se a dose estimada de consumo de sal de cozinha no Brasil, em 30 dias um indivíduo que substituir o sal de cozinha tradicional pelo sal rosa promove uma redução na quantidade de sódio ingerida, em mol, mais próxima de

Em uma condição específica de fermentação, obtém-se 80% de conversão em etanol que, após sua purificação, apresenta densidade igual a 0,80 g/mL. O melaço utilizado apresentou 50 kg de monossacarídeos na forma de glicose.
O volume de etanol, em litro, obtido nesse processo é mais próximo de
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
P3 O10 5− (aq) + 2 H2 O (l) → 3 PO4 3− (aq) + 4 H+ (aq)
O número de dias necessário para que o lago alcance a concentração máxima de fósforo (na forma de íon fosfato) permitida para o consumo humano está mais próximo de
A diferença de emissão de CO2 dos carros desse fabricante em relação ao limite estabelecido na União Europeia é
C2H5OH (I) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas em dois veículos, um movido a etanol e outro elétrico, em um mesmo trajeto de 1.000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro. Guaratinguetá: Unesp. 2015 (adaptado).
A quantidade equivalente de etanol economizada, em quilograma, com o uso do veículo elétrico nesse trajeto, é mais próxima de
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
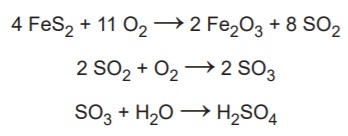
Qual é o valor mais próximo da massa de ácido sulfúrico, em quilograma, que será produzida a partir de 2,0 kg de ouro de tolo?
Um experimento simples, que pode ser realizado com materiais encontrados em casa, é realizado da seguinte forma: adiciona-se um volume de etanol em um copo de vidro e, em seguida, uma folha de papel. Com o passar do tempo, observa-se um comportamento peculiar: o etanol se desloca sobre a superfície do papel, superando a gravidade que o atrai no sentido oposto, como mostra a imagem. Para parte dos estudantes, isso ocorre por causa da absorção do líquido pelo papel.
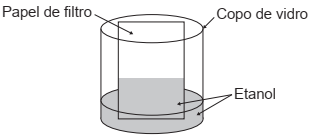
Do ponto de vista científico, o que explica o movimento
do líquido é a
As soluções de hipoclorito de sódio têm ampla aplicação como desinfetantes e alvejantes. Em uma empresa de limpeza, o responsável pela área de compras deve decidir entre dois fornecedores que têm produtos similares, mas com diferentes teores de cloro.
Um dos fornecedores vende baldes de 10 kg de produto granulado, contendo 65% de cloro ativo, a um custo de R$ 65,00. Outro fornecedor oferece, a um custo de R$ 20,00, bombonas de 50 kg de produto líquido contendo 10% de cloro ativo.
Considerando apenas o quesito preço por kg de cloro ativo e desprezando outras variáveis, para cada bombona de 50 kg haverá uma economia de
O aproveitamento integral e racional das matérias-primas lignocelulósicas poderá revolucionar uma série de segmentos industriais, tais como o de combustíveis, mediante a produção de bioetanol de segunda geração. Este processo requer um tratamento prévio da biomassa, destacando-se o uso de ácidos minerais diluídos. No pré-tratamento de material lignocelulósico por via ácida, empregou-se uma solução de ácido sulfúrico, que foi preparada diluindo-se 2 000 vezes uma solução de ácido sulfúrico, de concentração igual a 98 g/L, ocorrendo dissociação total do ácido na solução diluída. O quadro apresenta os valores aproximados de logaritmos decimais.
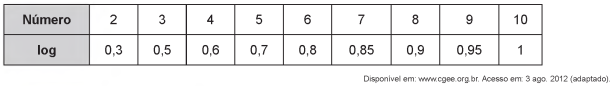
Sabendo-se que as massas molares, em g/mol, dos elementos H, O e S são, respectivamente, iguais a 1, 16 e 32,
qual é o pH da solução diluída de ácido sulfúrico preparada conforme descrito?
Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha.
A reação não balanceada que ocorre é:
Ag2S (s) + Al (s) → Al2S3 (s) + Ag (s)
Dados da massa molar dos elementos (g mol-1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral, orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é