Na busca por ouro, os garimpeiros se confundem facilmente e...
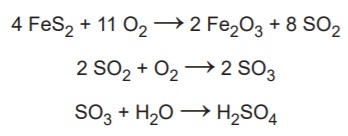
Qual é o valor mais próximo da massa de ácido sulfúrico, em quilograma, que será produzida a partir de 2,0 kg de ouro de tolo?
- Gabarito Comentado (1)
- Aulas (8)
- Comentários (10)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
Balanceando a equação e relacionando o ouro tolo com o acido fica:
4 mol de FeS2----------8 mol de H2SO4
4.120 g--------------------8.98.0,9 g (rendimento)
2.0,9(pureza)Kg--------X
X=2,6 aproximadamente
DICAS:
1-montar a equação
2-balancear
3-analisar qual unidade esta sendo relacionada,EX:
(mol com mol é o básico);(volume com volume);(massa com massa);etc.
4-aplicar os casos de estequiometria:
RENDIMENTO-multiplica direto na primeira linha da substância que é produzida.
PUREZA-multiplica na segunda linha do minério em questão.
OBS:o Kg não altera no final porque o grama será cortado.
Balanceando a equação e relacionando o ouro tolo com o acido fica:
4 mol de FeS2----------8 mol de H2SO4
4 . 120 ------ 8 . 98
0,9 . 2kg ---- x
x = 2,94 kg
Balanceando:
- Etapa 1: 4 FeS2 + 11 O2 --> 2 Fe2O3 + 8 SO2
- Etapa 2: 8 SO2 + 4 O2 --> 8 SO3 (multiplicando tudo por 4)
- Etapa 3: 8 SO3 + 8 H20 --> 8 H2SO4 (multiplicando tudo por 8)
Proporção:
- 4 mols de FeS2 — 8 mols de H2SO4
- 1 mol de FeS2 — 2 mols de H2SO4
Impurezas:
2 kg de pirita — 100% de pirita
x kg de pirita — 90% de FeS2 puro
x = 1,8 kg de FeS2 puro
Estequiometria:
120 g de FeS2 — 2 • (98 g) de H2SO4
1,8 kg de FeS2 — x kg de H2SO4
x = 2,94 kg de H2SO4
Rendimento de 90%
2,94 • 0,9 ≈ 2,64
O mais próximo é 2,6.
aqueles 90% no final é vagabundoô
90% MALDITOS 90 PORCENTOS.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo