Questões do Enem
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 31 questões
Considere as massas molares: NaCl = 58,5 g/mol; Na = 23 g/mol.
Qual é o valor mais próximo da massa, em grama, de cloreto de sódio presente em uma única colher pequena?
Do ponto de vista da química, a que se deve essa variação de volume?
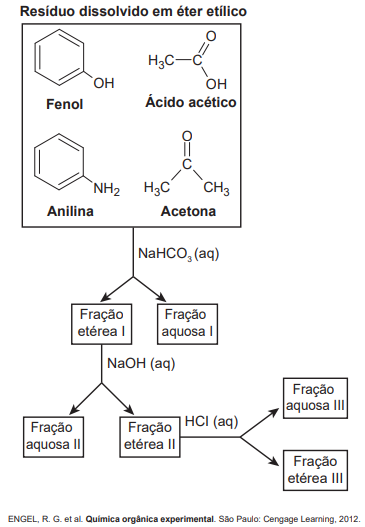
Os componentes do resíduo que estão presentes nas frações aquosas II e III são, respectivamente,
bula de um determinado medicamento traz as seguintes informações:

De acordo com as informações apresentadas na bula,
a substância que se encontra em maior concentração
e a não condutora de corrente elétrica, quando em
solução aquosa, são, respectivamente,
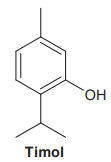
A dissolução desse composto em uma solução de hidróxido de sódio se deve ao(à)
Hg2(NO3 )2 (aq) + 2 NaCl (aq) ➝ Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
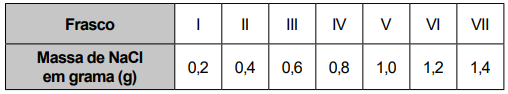
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2 (NO3 )2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg2Cl2 é 472 g mol–1.
Qual foi o gráfico obtido pelo assistente de laboratório?
Considere a massa molar da água igual a 18 g mol−1, e a massa molar do cloreto de cálcio anidro igual a 111 g mol−1.
Na hidratação da substância presente no antimofo, o ganho percentual, em massa, é mais próximo de
O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol L-1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação é representada pela equação química:
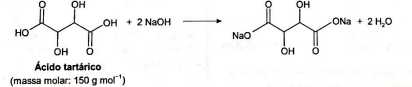
A concentração de ácido tartárico no vinho analisado é mais próxima de:
O etanol é um combustível produzido a partir da fermentação da sacarose presente no caldo de cana-de-açúcar. Um dos fatores que afeta a produção desse álcool é o grau de deterioração da sacarose, que se inicia após o corte, por causa da ação de microrganismos. Foram analisadas cinco amostras de diferentes tipos de cana-de-açúcar e cada uma recebeu um código de identificação. No quadro são apresentados os dados de concentração de sacarose e de microrganismos presentes nessas amostras.
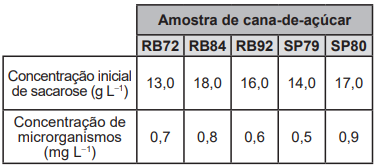
Pretende-se escolher o tipo de cana-de-açúcar que conterá o maior teor de sacarose 10 horas após o corte e que, consequentemente, produzirá a maior quantidade de etanol por fermentação. Considere que existe uma redução de aproximadamente 50% da concentração de sacarose nesse tempo, para cada 1,0mgL-1 de microrganismos presentes na cana-de-açúcar.
Disponível em: www.inovacao.unicamp.br. Acesso em: 11 ago. 2012 (adaptado)
Qual tipo de cana-de-açúcar deve ser escolhido?
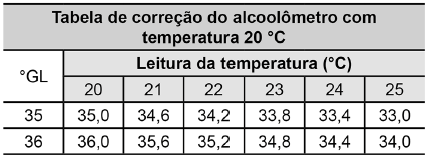 Manual alcoolômetro Gay Lussac. Disponível em: www.incoterm.com.br.
Acesso em: 4 dez. 2018 (adaptado).
Manual alcoolômetro Gay Lussac. Disponível em: www.incoterm.com.br.
Acesso em: 4 dez. 2018 (adaptado).
É necessária a correção da medida do instrumento, pois um aumento na temperatura promove o(a)
C2H5OH (I) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas em dois veículos, um movido a etanol e outro elétrico, em um mesmo trajeto de 1.000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro. Guaratinguetá: Unesp. 2015 (adaptado).
A quantidade equivalente de etanol economizada, em quilograma, com o uso do veículo elétrico nesse trajeto, é mais próxima de
Qual é a concentração de sacarose depois de 400 minutos do início da reação de hidrólise?
Que volume de larvicida deve conter o frasco plástico?
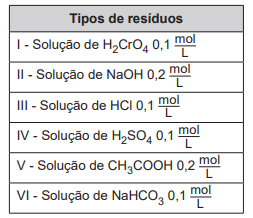
Qual combinação de resíduos poderá ser descartada na rede de esgotos?
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
Qual é o valor mais próximo para o volume de solução de Ca(Oh)2, em mL, que deve estar contido em cada ampola do kit para garantir a determinação da regularidade da amostra testada?
Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192 g mol−1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.
Polpa de fruta Valor mínimo da acidez total
expressa em ácido cítrico
(g/100 g)
Acerola 0,8
Caju 0,3
Cupuaçu 1,5
Graviola 0,6
Maracujá 2,5
A acidez total expressa em ácido cítrico de uma amostra comercial de polpa de fruta foi determinada. No procedimento, adicionou-se água destilada a 2,2 g da amostra e, após a solubilização do ácido cítrico, o sólido remanescente foi filtrado. A solução obtida foi titulada com solução de hidróxido de sódio 0,01 mol L−1, em que se consumiram 24 mL da solução básica (titulante).
BRASIL. Ministério da Agricultura e do Abastecimento. Instrução normativa n. 1, de 7 de janeiro de 2000. Disponível em: www.agricultura.gov.br. Acesso em: 9 maio 2019 (adaptado).
Entre as listadas, a amostra analisada pode ser de qual
polpa de fruta?
Sobre a diluição do ácido sulfúrico em água, o químico e escritor Primo Levi afirma que, “está escrito em todos os tratados, é preciso operar às avessas, quer dizer, verter o ácido na água e não o contrário, senão aquele líquido oleoso de aspecto tão inócuo está sujeito a iras furibundas: sabem-no até os meninos do ginásio”.
(furibundo: adj. furioso)
LEVI, P A tabela periódica. Rio de Janeiro: Relume-Dumará, 1994 (adaptado).
O alerta dado por Levi justifica-se porque a
A bauxita é o minério utilizado na fabricação do alumínio, a qual apresenta Al2O3 (alumina) em sua composição. Após o trituramento e lavagem para reduzir o teor de impurezas, o minério é misturado a uma solução aquosa de NaOH (etapa A). A parte sólida dessa mistura é rejeitada e a solução resultante recebe pequenos cristais de alumina, de onde sedimenta um sólido (etapa B). Esse sólido é aquecido até a obtenção de um pó branco, isento de água e constituído unicamente por alumina. Finalmente, esse pó é aquecido até sua fusão e submetido a uma eletrólise, cujos produtos são o metal puro fundido (Al) e o gás carbônico (CO2).
SILVA FILHO, E. B.; ALVES, M. C. M.; DA MOTTA, M. Lama vermelha da indústria de beneficiamento de alumina: produção, características, disposição e aplicações alternativas. Revista Matéria, n. 2, 2007.
Nesse processo, as funções das etapas A e B são, respectivamente,
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a