Questões Militares Sobre engenharia química e química industrial
Foram encontradas 255 questões
“A termodinâmica química estuda, entre outras coisas, as mudanças de energia que acompanham as reações químicas.”
(Fundamentos de Química Experimental, Maurício Gomes Constantino.)
Em relação à termoquímica, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A máxima quantidade de energia que um sistema químico pode produzir é medida pela variação de energia livre: ΔG.
( ) Na entalpia da transformação, as medidas são geralmente efetuadas não mantendo uma pressão constante e é representada como ΔH.
( ) Uma reação na qual o calor é absorvido (a temperatura da mistura de reação diminui quando reage) é chamada de endotérmica e o ΔH é positivo.
( ) Uma reação na qual o calor é perdido pelos reagentes para o meio ambiente (a temperatura da mistura de reação aumenta quando reage) é dita exotérmica, onde ΔH é negativo.
A sequência está correta em
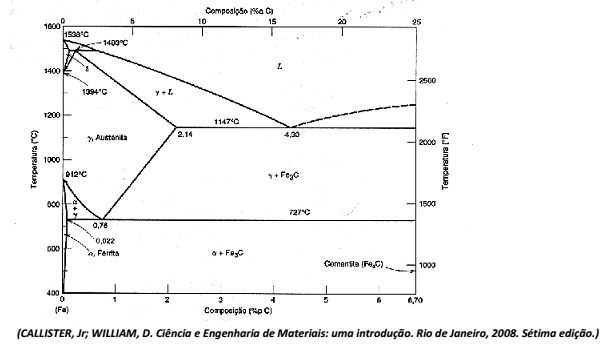
Para um aço contendo 81% de perlita, as porcentagens de ferrita e cementita são, respectivamente:
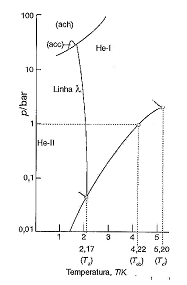
Sobre o diagrama de fases do hélio (4He), analise as afirmativas a seguir.
I. A linha λ assinala as condições para as quais a fase líquida e a fase sólida do hélio estão em equilíbrio. II. O He-II é um superfluido. III. As identificações ach e acc referem-se a fases sólidas distintas com estruturas diferentes do agrupamento dos átomos: uma delas é o agrupamento compacto hexagonal, ach; e a outra, o agrupamento compacto cúbico, acc.
Está(ão) correta(s) apenas a(s) afirmativa(s)
O estado mais simples da matéria é um gás, uma forma da matéria que ocupa qualquer recipiente que a contenha. É conveniente imaginar um gás como um conjunto de moléculas em movimento permanente e aleatório, com velocidades médias que aumentam quando a temperatura se eleva. Um gás difere de um líquido pelo fato de ter suas moléculas muito separadas umas das outras. Sobre os gases, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O tamanho das moléculas é desprezível no sentido de que seus diâmetros são muito menores do que a distância média percorrida entre as colisões.
( ) Um gás real tem o comportamento tanto mais semelhante ao de um gás perfeito quanto mais alta for a pressão.
( ) A velocidade média quadrática das moléculas de um gás é proporcional à raiz quadrada da temperatura e à raiz quadrada da massa molar.
( ) As leis de Boyle e de Charles são exemplos de uma lei limite.
A sequência está correta em
Alguns fatores ocorrem naturalmente, outras não. Um gás, por exemplo, se expande até ocupar todo o volume disponível que lhe é oferecido. Um corpo quente se resfria até atingir a temperatura das suas vizinhanças, e uma reação química avança preferencialmente num sentido e não no sentido inverso. O reconhecimento da existência de duas classes de processos, os espontâneos e os não espontâneos, é resumido pela Segunda Lei da Termodinâmica. Sobre o tema, analise as afirmativas a seguir.
(Considere: ln 2 = 0,69.
ln 2,8 = 1,03.)
I. A variação de entropia de um gás perfeito quando ele se expande isotermicamente do volume Vi até o volume Vf é 8,62 JK–1
II. A variação de entropia do argônio, que está inicialmente a 25°C e 1,00 bar, num recipiente de 0,500 dm3 de volume e que se expande até o volume de 1,000 dm3 , sendo simultaneamente aquecido até 100°C é 0,173 JK–1 .
III. Num ciclo termodinâmico, a variação global de uma função de estado (do estado inicial até o estado final e então de volta para o estado inicial) é igual a zero.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A lei que é usada para identificar o sentido da mudança espontânea, a segunda lei da termodinâmica, também se exprime em termos de uma função de estado, a entropia. A primeira lei usa a energia interna para identificar as mudanças permitidas; a segunda lei usa a entropia para identificar as mudanças espontâneas entre as mudanças permitidas.
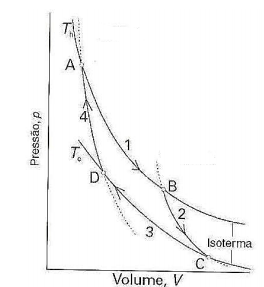
Sobre o ciclo de Carnot, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A variação de entropia é qh/Th, em que qh é a energia na forma de calor fornecida ao sistema pela fonte quente.
( ) Há troca de calor; a variação de entropia é nula.
( ) A variação de entropia do sistema é qc/Tc , qc é positivo.
( ) Não há troca térmica e, portanto, a variação de entropia é nula.
A sequência está correta em
CONSTANTES

DEFINIÇÕES


Um motor pulso-jato é uma máquina térmica que pode ser representada por um ciclo termodinâmico ideal de três etapas:
I. Aquecimento isocórico (combustão).
II. Expansão adiabática (liberação de gases).
III. Compressão isobárica (rejeição de calor a pressão atmosférica).
Considerando que essa máquina térmica opere com gases ideais, indique qual dos diagramas pressão versus volume a seguir representa o seu ciclo termodinâmico.
CONSTANTES

DEFINIÇÕES


Analise as afirmativas a seguir e assinale a opção correta, com relação à Primeira Lei da Termodinâmica.
I- A energia interna U de um sistema só pode ser alterada pela transferência de calor entre o sistema e a vizinhança.
II- Quando um sistema recebe calor, sua energia interna aumenta e, quando ele perde calor, sua energia interna diminui.
III- Durante uma expansão adiabática, o gás realiza trabalho sobre as vizinhanças.
IV- Quando trabalho é feito sobre o sistema, sua energia interna diminui e, quando um sistema realiza trabalho, sua energia interna aumenta.
Observe a figura a seguir.
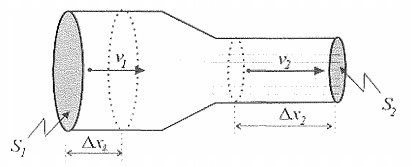
Um fluido incompressível, com densidade igual a 10Kg/m3,
conforme ilustrado acima, flui de S1 para S2, onde a seção de
S1 mede 8m2 e a seção de S2 mede 4m2. Sabendo que a diferença
de pressão entre S1 e S2 é de 2 , 4Pa, qual é o valor da
velocidade do fluido, em m/s na seção S2?
Observe as figuras a seguir.
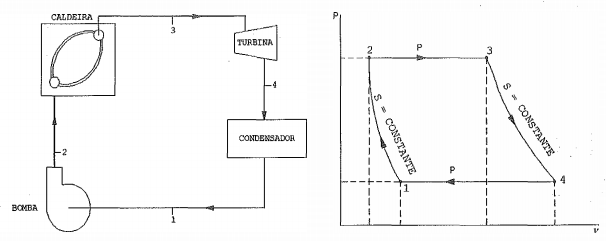
No ciclo ideal Rankine acima representado, o vapor d ’água deixa a caldeira e entra na turbina como vapor superaquecido a 5MPa e 500°C. A pressão no condensador é de 25kPa. Admita que os processos desse ciclo ocorram em regime permanente e com variações desprezíveis de energias cinética e potencial. Nessas condições e utilizando o critério de arredondamento na primeira casa decimal, calcule o rendimento do ciclo e assinale a opção correta.
Dados:

Considere um equipamento condicionador de ar operando segundo um ciclo de Carnot para manter um ambiente a 27°C„ A carga térmica a ser removida desse ambiente interno é de 6000W„ Sabendo que o ambiente externo está a 37 °C, determine a potência mínima (em W) necessária para acionar esse equipamento, e assinale a opção correta.
Dado :
T(K) = T(°C)+273
Com relação aos fundamentos de trocadores de calor, classificados em função da configuração do escoamento e do tipo de construção desses equipamentos, analise as afirmativas abaixo .
I - Em um trocador de calor de tubos concêntricos, a configuração paralela refere-se à situação em que os fluidos quente e frio entram pela mesma extremidade, escoam no mesmo sentido e deixam o equipamento também na mesma extremidade. Já na configuração contracorrente, os fluidos entram por extremidades opostas, escoam em sentidos opostos e também saem do equipamento em extremidades opostas.
II - Existem trocadores de calor tubulares com e sem aletas. Em um trocador com feixe tubular aletado, as aletas permitem a mistura do fluido, ou seja, o movimento do fluido ocorre na direção transversal à do escoamento principal, o que faz a temperatura variar em ambas as direções . Já em um trocador com feixe tubular não-aletado, o fluido não se movimenta na direção transversal, o que impede a mistura e a variação de temperatura com o fluido na direção principal do escoamento.
III- Em um trocador de calor de casco e tubos, geralmente, são instaladas chicanas para aumentar o coeficiente convectivo no fluido do lado do casco, o que induz turbulência e um componente de velocidade na direção do escoamento cruzado. As chicanas apoiam fisicamente os tubos , reduzindo a vibração desses tubos provocada pelo e s coamento.
Assinale a opção correta.