Questões Militares Sobre engenharia química e química industrial
Foram encontradas 255 questões
As características das fases em um sistema imiscível são ilustradas no diagrama temperatura / composição.

As características das fases em um sistema imiscível são ilustradas no diagrama temperatura / composição.

A respeito dos diagramas, informe se as afirmativas abaixo são verdadeiras (V) ou falsas (F) e, em seguida, assinale a alternativa que apresenta a seqüência correta.
( ) No ponto de orvalho, o líquido 1 puro começa a se condensar.
( ) No ponto E, o vapor restante se condensa na temperatura T* , produzindo duas fases líquidas, uma da espécie 1 pura e outra da espécie 2 pura.
( ) Um posterior aumento na temperatura na direção de T* causa a condensação continuada do líquido 1 puro.
( ) O líquido 1 puro se condensa primeiro.
A energia das moléculas individuais inclui-se dentro de uma distribuição de energia em que algumas moléculas têm mais energia do que as outras. Esse tipo de distribuição é apresentado na figura a seguir.
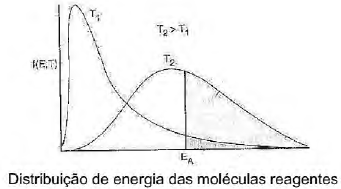
Sobre a distribuição de energia das moléculas reagentes, analise as afirmativas.
I. A função f(E, T) é mais facilmente interpretada identificando-se (f.dE) como a fração de moléculas que tem energia entre E e (E+dE).
II. As moléculas na área sombreada contêm energia cinética suficiente para causar a ruptura das ligações e então ocorrer a reação.
III. À medida que a temperatura diminui, mais moléculas contêm energia suficiente para reagir e a velocidade de reação cresce.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A figura a seguir mostra o ciclo de quatro etapas em um diagrama p-v e também em um diagrama T-s; analise-a.

Um mol de gás hidrogênio, a 27 °C em um sistema fechado, se expande isotermicamente contra uma pressão externa constante igual a 1 atm, até duplicar o seu volume inicial. Qual é o calor necessário para manter constante a temperatura do gás, sabendo que a pressão final do gás é 1 atm?
Dados : ΔU = Q - W
W = PextΔV
PV = nRT
T(K) = T(°C) + 273
R = 0,082 atm•L • mol-1 • K-1
1atm = 105 N • m-2
Marque a alternativa correta.
A variação de entropia mede o grau de desordem em um processo. A seguir são apresentados alguns processos físicos ou químicos.
I. H2O(ℓ) → H2O(g)
II. H2O(ℓ) a 20 oC → H2O(ℓ) a 80 oC
III. NaCℓ(s) + H2O(ℓ) → Na+(aq) + Cℓ(aq)
IV. 2NH3(g) N2(g) + 3H2(g)
As equações que representam aumento de entropia são:
A variação de entropia de um sistema fechado constituído por um gás ideal, quando sofre uma transformação, pode ser calculada pela expressão genérica:
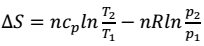
em que os subscritos 1 e 2 representam dois estados quaisquer. Assinale a única afirmativa correta.
Um reservatório de 4 metros de altura, com a sua extremidade superior aberta, encontra-se cheio com um fluido incompressível de densidade ρ = 2 Kg/m3. Se o reservatório possui em sua base um pequeno orifício circular, então a velocidade de escape na região cilíndrica do jato de saída é
Considere a aceleração
da gravidade g=10m/s2.